题目内容
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、常温下,pH=7的任何溶液中含有OH-数目均为10-7NA |
| B、23g乙醇中含有C-H键的数目为3NA |
| C、4.8g O2和O3以任何比例组成的混合气体中含有的氧原子数目均为0.3NA |
| D、常温常压下,2.24L Cl2与足量铁粉充分反应,转移的电子数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.题中缺少溶液的体积,无法计算溶液中氢氧根离子数目;
B.乙醇的结构式为 ,乙醇分子中存在5个碳氢键,0.5mol乙醇中含有2.5mol碳氢键;
,乙醇分子中存在5个碳氢键,0.5mol乙醇中含有2.5mol碳氢键;
C.4.8g氧气和臭氧的混合物中含有4.8g氧原子,含有0.3mol氧原子;
D.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量.
B.乙醇的结构式为
 ,乙醇分子中存在5个碳氢键,0.5mol乙醇中含有2.5mol碳氢键;
,乙醇分子中存在5个碳氢键,0.5mol乙醇中含有2.5mol碳氢键;C.4.8g氧气和臭氧的混合物中含有4.8g氧原子,含有0.3mol氧原子;
D.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量.
解答:
解:A.没有告诉溶液的体积,无法计算溶液中氢氧根离子的物质的量及数目,故A错误;
B.23g乙醇的物质的量为0.5mol,0.5mol乙醇中含有2.5mol碳氢键,含有C-H键的数目为2.5NA,故B错误;
C.4.8g O2和O3以任何比例组成的混合气体中含有4.8g氧原子,含有氧原子的物质的量为0.3mol,含有的氧原子数目均0.3NA,故C正确;
D.不是标准状况下,不能使用标况下的气体摩尔体积计算2.24L氯气的物质的量,故D错误;
故选C.
B.23g乙醇的物质的量为0.5mol,0.5mol乙醇中含有2.5mol碳氢键,含有C-H键的数目为2.5NA,故B错误;
C.4.8g O2和O3以任何比例组成的混合气体中含有4.8g氧原子,含有氧原子的物质的量为0.3mol,含有的氧原子数目均0.3NA,故C正确;
D.不是标准状况下,不能使用标况下的气体摩尔体积计算2.24L氯气的物质的量,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化关系,明确标况下气体摩尔体积的使用条件,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
水溶液中能大量共存的一组离子是( )
| A、K+、H+、I-、ClO- |
| B、Na+、Fe3+、SO42-、OH- |
| C、Al3+、NH4+、AlO2-、NO3- |
| D、Mg2+、Ca2+、HCO3-、Br- |
已知电离常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>I2.下列对有关反应或离子反应方程式的叙述正确的是( )
| A、Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
| B、向氯化铁溶液中加氢碘酸能使溶液变为无色 |
| C、向NaClO溶液中通入少量的CO2:2ClO-+CO2+H2O═2HClO+CO32- |
| D、200mL 2mol/L的FeBr2溶液中通入11.2L标准状况下的Cl2:4Fe2++2Br-+5Cl2═4Fe3++3Br2+10Cl- |
常温下,下列各组离子在溶液中一定能大量共存的是( )
| A、Ca2+、K+、CO32-、Cl- |
| B、K+、NH4+、HCO3-、OH- |
| C、H+、Fe2+、ClO-、SO42- |
| D、Na+、Ba2+、OH-、NO3- |
下列关于常见有机物的说法中,不正确的是( )
| A、苯和乙烯都能与氢气发生加成反应 |
| B、淀粉和蛋白质都是人体重要的营养物质 |
| C、乙酸和乙醇都能与氢氧化钠溶液反应 |
| D、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、PM2.5颗粒直径约是原子直径的2.5倍 |
| B、淀粉、蔗糖、氨基酸在一定条件都能发生水解反应 |
| C、植物油通常能和氢氧化钠溶液发生反应 |
| D、应该倡议禁止向绿色食品中添加任何化学物质 |




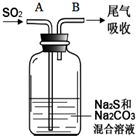 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: