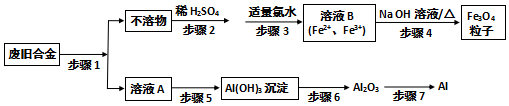
题目内容
6.下列实验操作以及实验现象完全一致的是( )| A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
| B | 向饱和碳酸钠溶液中通入过量CO2气体 | 有白色细小晶体析出 |
| C | 将新制氯水滴到蓝色石蕊试纸上 | 试纸变红 |
| D | 将用砂子打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na与硫酸铜溶液反应生成氢氧化铜、氢气、硫酸钠;
B.向饱和碳酸钠溶液中通入过量CO2气体,析出碳酸氢钠;
C.氯水中含盐酸、HClO,HClO具有漂白性;
D.氧化铝的熔点高,包裹在Al的外面.
解答 解:A.Na与硫酸铜溶液反应生成氢氧化铜、氢气、硫酸钠,则有蓝色沉淀生成,故A错误;
B.向饱和碳酸钠溶液中通入过量CO2气体,析出碳酸氢钠,则有白色细小晶体析出,故B正确;
C.氯水中含盐酸、HClO,HClO具有漂白性,则先变红后褪色,故C错误;
D.氧化铝的熔点高,包裹在Al的外面,则铝熔化但不滴落,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质性质、反应与现象、实验操作为解答的关键,侧重分析与实验能力的考查,注意实验与元素化合物知识的结合,题目难度不大.

练习册系列答案
相关题目
16.对于某些离子的检验及结论一定正确的是( )
| A. | 某物质进行焰色反应时呈现黄色,则该物质中一定含有Na+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液中不一定含有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
17.废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-═N2+3Cl-+2H++3H2O.下列说法中,不正确的是( )
| A. | 反应中氮元素被氧化,氯元素被还原 | |
| B. | 还原性 NH4+>Cl- | |
| C. | 反应中每生成1 mol N2,转移6 mol电子 | |
| D. | 经此法处理过的废水可以直接排放 |
14.下列化学用语表述正确的是( )
| A. | 二氧化碳的结构式:O=C=O | B. | 氯化氢的电子式: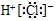 | ||
| C. | ${\;}_{1}^{3}$H的原子结构示意图: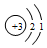 | D. | 水的电离方程式:H2O=H++OH- |
1.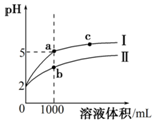 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )| A. | 曲线I代表盐酸的稀释过程 | |
| B. | a溶液的导电性比c溶液的导电性强 | |
| C. | a溶液中和氢氧化钠的能力强于b溶液 | |
| D. | 将a、b两溶液加热至30℃,$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变小 |
18.如图为一种微生物燃料电池结构示意图,下列叙述正确的是( )
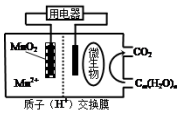

| A. | 放电过程中,电子从正极转移到负极 | |
| B. | 放电过程中,H+从正极区移向负极区 | |
| C. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,消耗的葡萄糖是1mol |
15.下列仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
16.向含amol H2S水溶液中通入bmol Cl2,当通入的Cl2少量时,产生浅黄色浑浊,增加通入Cl2的量,浅黄色浑浊逐渐消失,最后成为无色溶液,却溶液呈强酸性,下列说法不正确的是( )
| A. | 当b≤a时,发生的离子方程式:H2S+Cl2=2H++S↓+2Cl- | |
| B. | 当2a=b时,发生的离子方程式:3H2S+6Cl2+4H2O=14H++2S↓+SO42-+12Cl- | |
| C. | 当a≤b≤4a时,反应中转移电子的物质的量n(e-)为2amol≤n(e-)≤8amol | |
| D. | 当a<b<4a时,溶液中的S、SO42-、Cl-的物质的量比为(4a-b):(b-a):2b |