题目内容
11.利用废旧铝铁合金(主要成分为Fe、Al、Fe2O3、Al2O3)制备纳米材料磁性Fe3O4粒子及副产物Al,制备流程图如图: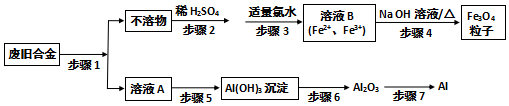
回答下列问题:
(1)步骤1中所用的试剂是NaOH溶液,涉及的化学反应中属于氧化还原反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)步骤3中反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(3)步骤5可选用的试剂或操作最合理的是d(填序号).
a.NaOH溶液 b.氨水 c.盐酸 d.通入过量的CO2
(4)步骤7中每获得副产物Al 27g,转移的电子数目为3NA或1.806×1024.
(5)下列关于磁性Fe3O4粒子的说法正确的是D(填序号).
A.磁性Fe3O4粒子会产生丁达尔效应
B.磁性Fe3O4粒子的化学性质与原来的Fe3O4完全不同
C.磁性Fe3O4粒子属于胶体分散系
D.磁性Fe3O4粒子能透过滤纸.
分析 废旧铝铁合金(主要成分为Fe、Al、Fe2O3、Al2O3),加入氢氧化钠溶液其中Al、Al2O3溶于氢氧化钠溶液,Fe、Fe2O3不溶于氢氧化钠,过滤得到不溶物为Fe、Fe2O3,加入稀硫酸溶解后加入适量氯水,氧化亚铁离子为铁离子得到亚铁离子和铁离子的混合溶液,加入氢氧化钠溶液加热过滤得到四氧化三铁粒子,溶液A为NaAlO2溶液,通入过滤二氧化碳气体生成氢氧化铝沉淀,灼烧得到氧化铝,电极熔融氧化铝得到金属铝和氧气,
(1)分析可知步骤1是加入氢氧化钠溶液溶解Al、Al2O3,发生氧化还原反应的是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)步骤3是氯气氧化亚铁离子生成铁离子;
(3)步骤5是偏铝酸钠溶液中通入过滤二氧化碳气体生成氢氧化铝沉淀的反应;
(4)步骤7是电解熔融氧化铝结合化学方程式定量关系计算电子转移数;
(5)A.磁性Fe3O4粒子不是胶体;
B.磁性Fe3O4粒子的化学性质与原来的Fe3O4相同;
C.磁性Fe3O4粒子为纳米级,不属于胶体分散系
D.磁性Fe3O4粒子能透过滤纸.
解答 解:(1)分析可知步骤1是加入氢氧化钠溶液溶解Al、Al2O3,发生氧化还原反应的是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:NaOH溶液;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)步骤3中反应的离子方程式为氯气氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe2++Cl2=2 Fe3++2Cl-,
故答案为:2Fe2++Cl2=2 Fe3++2Cl-;
(3)步骤5可选用的试剂是形成氢氧化铝沉淀,
a.NaOH溶液和偏铝酸钠,故a错误;
b.氨水和偏铝酸钠不反应不能生成氢氧化铝沉淀,故b错误;
c.盐酸和偏铝酸钠溶液反应,但生成的氢氧化铝可以溶于过量的盐酸,不是最好,故c错误;
d.通入过量的CO2 和偏铝酸钠溶液反应生成氢氧化铝沉淀,能全部沉淀铝离子,故d正确;
故答案为:d;
(4)步骤7是电解熔融氧化铝,反应的化学方程式为:2Al2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Al+3O2↑,生成4molAl,电子转移12mol,产物Al 27g物质的量=$\frac{27g}{27g/mol}$=1mol,电子转移3mol即为3NA或1.806×1024,
故答案为:3NA 或1.806×1024;
(5)A.磁性Fe3O4粒子不是胶体,故A错误;
B.磁性Fe3O4粒子的化学性质与原来的Fe3O4相同,故B错误;
C.磁性Fe3O4粒子为纳米级,不属于胶体分散系,故C错误;
D.磁性Fe3O4粒子属于纳米级能透过滤纸,故D正确;
故答案为:D;
点评 本题考查了物质分离提纯、主要是铁及其化合物、铝及其化合物性质、掌握基础是解题关键,题目难度中等.

| A. | 加热前后一样多 | B. | 加热前消耗的多 | ||
| C. | 加热后消耗的多 | D. | 当Na2O2适量时才会一样多无法 |
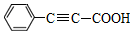 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )| A. | 分子式为C9H7O2 | |
| B. | 与丙炔酸(CH≡C-COOH)互为同系物 | |
| C. | 是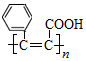 高分子化合物的单体 高分子化合物的单体 | |
| D. | 1 mol苯丙炔酸最多可与4mol氢气发生反应 |
| A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
| B | 向饱和碳酸钠溶液中通入过量CO2气体 | 有白色细小晶体析出 |
| C | 将新制氯水滴到蓝色石蕊试纸上 | 试纸变红 |
| D | 将用砂子打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落 |
| A. | A | B. | B | C. | C | D. | D |
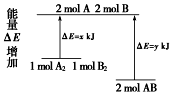
| A. | 该反应的反应热△H=x-y kJ/mol | |
| B. | 断裂1 mol A-A键和1 mol B-B键放出x kJ能量 | |
| C. | 2 mol AB的总能量高于1 mol A2和1 mol B2总能量 | |
| D. | 该反应是吸热反应 |
| A. | 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+═2Fe2+ | |
| B. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-═BaSO4↓+H2O |
| A. | 二氧化锰和浓盐酸共热制氯气 | B. | 煅烧黄铁矿(FeS2)制SO2 | ||
| C. | 氯气与石灰乳反应制漂白粉 | D. | 电解熔融氯化镁制金属镁 |
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示: