题目内容
16.向含amol H2S水溶液中通入bmol Cl2,当通入的Cl2少量时,产生浅黄色浑浊,增加通入Cl2的量,浅黄色浑浊逐渐消失,最后成为无色溶液,却溶液呈强酸性,下列说法不正确的是( )| A. | 当b≤a时,发生的离子方程式:H2S+Cl2=2H++S↓+2Cl- | |
| B. | 当2a=b时,发生的离子方程式:3H2S+6Cl2+4H2O=14H++2S↓+SO42-+12Cl- | |
| C. | 当a≤b≤4a时,反应中转移电子的物质的量n(e-)为2amol≤n(e-)≤8amol | |
| D. | 当a<b<4a时,溶液中的S、SO42-、Cl-的物质的量比为(4a-b):(b-a):2b |
分析 当通入的Cl2少量时,产生浅黄色浑浊,发生氧化还原反应为:H2S+Cl2=2H++S↓+2Cl-,即b≤a;
当增加通入Cl2的量,浅黄色浑浊逐渐消失,最后成为无色溶液,却溶液呈强酸性,则发生氧化还原反应为:H2S+4Cl2+4H2O=10H++SO42-+8Cl-,即b≥4a;
所以当a≤b≤4a时,S和SO42-都生成,由此分析解答.
解答 解:A、当b≤a时,则Cl2少量,产生浅黄色浑浊,发生的离子方程式:H2S+Cl2=2H++S↓+2Cl-,故A正确;
B、当2a=b时,S和SO42-都生成,发生的离子方程式:3H2S+6Cl2+4H2O=14H++2S↓+SO42-+12Cl-,故B正确;
C、全生成S转移电子的物质的量n(e-)为2amol,全生成SO42-转移电子的物质的量n(e-)为8amol,所以当a≤b≤4a时,S和SO42-都生成,反应中转移电子的物质的量n(e-)为2amol≤n(e-)≤8amol,故C正确;
D、当a<b<4a时,设溶液中的S、SO42-、Cl-的物质的量比为x:(a-x):2b,根据得失电子守恒有2x+8(a-x)=2b,解得x=$\frac{4a-b}{3}$,所以溶液中的S、SO42-、Cl-的物质的量比为(4a-b):(b-a):6b,故D错误;
故选D.
点评 本题考查离子反应及氧化还原反应,把握氯气的量分析离子反应为解答的关键,明确少量、过量氯气发生对应的反应即可解答,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列实验操作以及实验现象完全一致的是( )
| A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
| B | 向饱和碳酸钠溶液中通入过量CO2气体 | 有白色细小晶体析出 |
| C | 将新制氯水滴到蓝色石蕊试纸上 | 试纸变红 |
| D | 将用砂子打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落 |
| A. | A | B. | B | C. | C | D. | D |
4.有一包实验室回收的固体粉末,可能含有Na2CO3、NaCl、CuSO4、FeCl3、FeCl2、MgCl2、Na2SO4中的一种或几种,现进行如下实验:
①取少量固体溶于水中,得到澄清透明溶液.
②取少量上述溶液三份,在其中一份溶液中滴加BaCl2溶液,出现白色沉淀,再加入稀盐酸,沉淀不溶解.
③第二份溶液中滴加硝酸酸化的AgNO3,有白色沉淀.
④第三份溶液中滴加KSCN不显红色,再滴加双氧水,溶液显血红色
下列说法正确的是( )
①取少量固体溶于水中,得到澄清透明溶液.
②取少量上述溶液三份,在其中一份溶液中滴加BaCl2溶液,出现白色沉淀,再加入稀盐酸,沉淀不溶解.
③第二份溶液中滴加硝酸酸化的AgNO3,有白色沉淀.
④第三份溶液中滴加KSCN不显红色,再滴加双氧水,溶液显血红色
下列说法正确的是( )
| A. | 固体中一定不含有CuSO4、FeCl3 | |
| B. | 固体中一定不含有Na2CO3、一定含有Na2SO4 | |
| C. | 固体中一定含有FeCl2,不一定含有NaCl | |
| D. | 要检验固体中有没有MgCl2,需再取一份溶液,滴加NaOH溶液,若产生白色沉淀,则含有MgCl2 |
11.下列有关能源的说法不正确的是( )
| A. | 煤、石油、天然气、氢能中,其中氢能是可再生能源 | |
| B. | 生物质能包括农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等 | |
| C. | 贮氢合金的发现和应用,解决了氢气贮存、运输的难题 | |
| D. | 生物质能通过直接燃烧产生热量,能量利用效率较高 |
1.下列各个反应,不能用于工业生产的是( )
| A. | 二氧化锰和浓盐酸共热制氯气 | B. | 煅烧黄铁矿(FeS2)制SO2 | ||
| C. | 氯气与石灰乳反应制漂白粉 | D. | 电解熔融氯化镁制金属镁 |
8.中药狼巴草的成分之一M具有清炎杀菌作用,M的结构简式如图所示: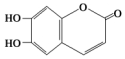 ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | M的分子式为C9H6O4 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 molM最多能与4 mol氢氧化钠反应 | |
| D. | M既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
13.下列有关水的电离的叙述中正确的是( )
| A. | H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| B. | 纯液态水中,一定存在Kw=[H+][OH-] | |
| C. | 纯液态水中,一定存在[H+][OH-]=1×10-14mol2•L-2 | |
| D. | 25℃,[H+]=1×10-7mol•L-1的液体一定是纯水 |
 请回答:
请回答: