题目内容
将一定量的晶体A隔绝空气加热到2000C,完全分解为等物质的量的B、C、D、E四种气体,C是一种非极性分子.如图表示各物质间的转化关系,图中部分反应条件及生成物没有列出.请按要求填空:
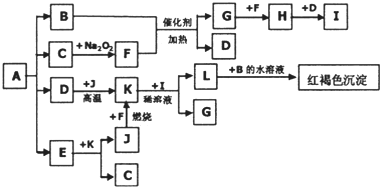
(1)单质J的化学式为 ,C分子的结构式为 .
(2)写出下列反应的化学方程式:
B+F ;D+Na2O2 .
(3)写出K与I的稀溶液反应的离子方程式 .
(4)A的化学式为 .

(1)单质J的化学式为
(2)写出下列反应的化学方程式:
B+F
(3)写出K与I的稀溶液反应的离子方程式
(4)A的化学式为
考点:无机物的推断
专题:推断题
分析:C是一种非极性分子且能与过氧化钠反应,C应为CO2,则F为O2,B可与氧气在催化剂条件下加热反应得到G与D,B能与氧气继续反应,则B为NH3,G为NO,D为H2O,H为NO2,I为HNO3.L与B反应得到红褐色沉淀为Fe(OH)3,D(H2O)与J在高温下反应,结合转化关系,根据Fe元素守恒可知,J为Fe,K为Fe3O4,L为Fe(NO3)3,E可K与反应生成Fe和CO2,则E具有还原性,应为CO,晶体A隔绝空气加热到200°C时,全部分解为B、C、D、E四种气体,且其物质的量相等,则A应为NH4HC2O4,结合对应物质的性质以及题目要求解答该题.
解答:
解:C是一种非极性分子且能与过氧化钠反应,C应为CO2,则F为O2,B可与氧气在催化剂条件下加热反应得到G与D,G能与氧气继续反应,则B为NH3,G为NO,D为H2O,H为NO2,I为HNO3.L与B反应得到红褐色沉淀为Fe(OH)3,D(H2O)与J在高温下反应,结合转化关系,根据Fe元素守恒可知,J为Fe,K为Fe3O4,L为Fe(NO3)3,E可K与反应生成Fe和CO2,则E具有还原性,应为CO,晶体A隔绝空气加热到200°C时,全部分解为B、C、D、E四种气体,且其物质的量相等,则A应为NH4HC2O4,
(1)由以上分析可知,J为Fe,C为CO2,其结构式为O=C=O,故答案为:Fe;O=C=O;
(2)B和F反应的化学方程式为4NH3+5O2
4NO+6H2O,D和Na2O2反应的化学方程式为2H2O+2Na2O2=4NaOH+O2↑,
故答案为:4NH3+5O2
4NO+6H2O;2H2O+2Na2O2=4NaOH+O2↑;
(3)Fe3O4与稀硝酸反应的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(4)由以上分析可知,A为NH4HC2O4,故答案为:NH4HC2O4.
(1)由以上分析可知,J为Fe,C为CO2,其结构式为O=C=O,故答案为:Fe;O=C=O;
(2)B和F反应的化学方程式为4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(3)Fe3O4与稀硝酸反应的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(4)由以上分析可知,A为NH4HC2O4,故答案为:NH4HC2O4.
点评:本题考查无机物的推断,题目突破口不明显,需要学生熟练掌握元素化合物知识,侧重于学生的分析能力和元素化合物知识的综合运用,注意根据物质的颜色、状态及特殊的转化关系为突破口进行推断,难度较大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、铝和稀盐酸反应:Al+2H+=Al3++H2↑ | ||
B、稀硝酸和碳酸钙反应:2H++CO
| ||
C、氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO
| ||
| D、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |

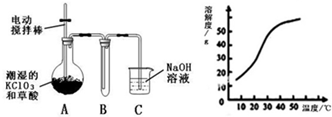 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.

 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:
,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题: