题目内容
有机物A燃烧只生产CO2和H2O.现取一定量的A在6.72L氧气(标准状况)中充分燃烧,燃烧后的产物先通过足量浓硫酸,浓硫酸增重3.6g,再通过足量的碱石灰,碱石灰增重8.8g,最后剩余2.24L气体(标准状况).
(1)A的实验式为
(2)所取A的物质的量为0.1mol,则分子式为
(3)其红外光谱图显示A中有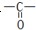 和C-OH两种原子团,A可能的结构简式为(写出一种即可) .
和C-OH两种原子团,A可能的结构简式为(写出一种即可) .
(1)A的实验式为
(2)所取A的物质的量为0.1mol,则分子式为
(3)其红外光谱图显示A中有
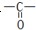 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)有机物A燃烧只生产CO2和H2O,现取一定量的A在6.72L氧气(标准状况)中充分燃烧,最后剩余2.24L气体(标准状况)为氧气,浓硫酸增重3.6g为生成的水的质量,碱石灰增重8.8g为燃烧生成CO2的质量,根据C原子、H原子、O原子守恒计算即求出的实验式;
(2)所取A的物质的量为0.1mol,结合生成的二氧化碳、水的量即可解答;
(3)根据分子式结合题干信息两种原子团,羧基以及羟基和醛基的关系分析可能的结构简式.
(2)所取A的物质的量为0.1mol,结合生成的二氧化碳、水的量即可解答;
(3)根据分子式结合题干信息两种原子团,羧基以及羟基和醛基的关系分析可能的结构简式.
解答:
解:(1)生成水的物质的量为n(H2O)=
=0.2mol,含有0.2mol氧原子,所以n(H)=2n(H2O)=0.2mol×2=0.4mol,生成CO2的物质的量为n(CO2)=
=0.2mol,所以n(C)=n(CO2)=0.2mol,含有0.4mol氧原子,有机物A燃烧只生产CO2和H2O,则最后剩余2.24L气体(标准状况)为氧气,消耗的氧气为n=
=
=0.2mol,含0.4mol氧原子,则有机物A中含有氧原子为0.2mol+0.4mol-0.4mol=0.2mol,C原子、H原子、O原子的个数比为0.2mol:0.4mol:0.2mol=1:2:1,实验式为CH2O,
故答案为:CH2O;
(2)根据(1)分析可知,0.1molA含有碳0.2mol,含有氢原子0.4mol,含有氧原子0.2mol,则1molA含有碳2mol,含有氢原子4mol,含有氧原子2mol,
所以A分子式为C2H4O2,故答案为:C2H4O2;
(3)A分子式为C2H4O2,A中有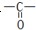 和C-OH两种原子团,所以A可能为羧酸或羟醛物质,羧酸应为CH3COOH,一个羧基可拆成一个羟基和一个醛基,所以含有羟基和醛基的物质为CH2(OH)CHO,故答案为:CH3COOH或CH2(OH)CHO.
和C-OH两种原子团,所以A可能为羧酸或羟醛物质,羧酸应为CH3COOH,一个羧基可拆成一个羟基和一个醛基,所以含有羟基和醛基的物质为CH2(OH)CHO,故答案为:CH3COOH或CH2(OH)CHO.
| 3.6g |
| 18g/mol |
| 8.8g |
| 44g/mol |
| v |
| vm |
| 4.48L |
| 22.4L/mol |
故答案为:CH2O;
(2)根据(1)分析可知,0.1molA含有碳0.2mol,含有氢原子0.4mol,含有氧原子0.2mol,则1molA含有碳2mol,含有氢原子4mol,含有氧原子2mol,
所以A分子式为C2H4O2,故答案为:C2H4O2;
(3)A分子式为C2H4O2,A中有
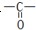 和C-OH两种原子团,所以A可能为羧酸或羟醛物质,羧酸应为CH3COOH,一个羧基可拆成一个羟基和一个醛基,所以含有羟基和醛基的物质为CH2(OH)CHO,故答案为:CH3COOH或CH2(OH)CHO.
和C-OH两种原子团,所以A可能为羧酸或羟醛物质,羧酸应为CH3COOH,一个羧基可拆成一个羟基和一个醛基,所以含有羟基和醛基的物质为CH2(OH)CHO,故答案为:CH3COOH或CH2(OH)CHO.
点评:本题考查有机物的确定,题目难度中等,注意从质量守恒的角度计算,把握羧基与羟基、醛基之间的关系.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )
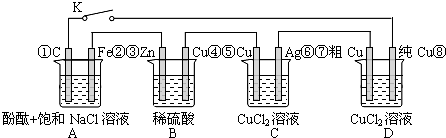

| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |
现有装有物质的量浓度为1.2mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲、乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( )
| A、1.08克 |
| B、1.44克 |
| C、1.8 克 |
| D、无法计算 |
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
| A、央视曝光“毒胶囊”事件,主要是其中重金属含量超标,重金属对人体危害主要是使蛋白质变性 |
| B、大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、针对H7N9流感的扩散情况,常选用含氯消毒剂、双氧水等物质进行消毒预防 |


 某装置如图所示,该装置工作过程中,下列判断错误的是( )
某装置如图所示,该装置工作过程中,下列判断错误的是( )