题目内容
6.在常温下,将VmL0.05mol.L-1的醋酸溶液缓慢滴加到10mol0.05mol•L-1的Na2CO3溶液中,并不断搅拌(气体完全逸出),所得溶液中微粒的物质的量浓度关系正确的( )| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.当V=10时,得到等浓度的CH3COONa、NaHCO3混合溶液,由于醋酸的酸性比碳酸的强,HCO3-的水解程度大于CH3COO-的水解程度;
B.溶液呈电中性,一定存在电荷守恒,结合含有的离子判断;
C.当 V=20 时,得到CH3COONa溶液,结合水电离的氢离子、氢氧根相等判断;
D.当 V=40 时,得到等浓度的CH3COONa、CH3COOH混合溶液,醋酸的电离程度大于CH3COO-的水解程度,溶液呈酸性.
解答 解:A.当V=10时,得到等浓度的CH3COONa、NaHCO3混合溶液,醋酸根、碳酸氢根水解,溶液呈碱性,由于醋酸的酸性比碳酸的强,HCO3-的水解程度大于CH3COO-的水解程度,水解程度是微弱的,则溶液中:c(Na+)>c(CH3COO-)>c(HCO3-)>c(OH-)>c(H+),故A错误;
B.溶液呈电中性,一定存在电荷守恒,则溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(HCO3-)+2c(CO32-)+c(OH-),故B正确;
C.当 V=20 时,得到CH3COONa溶液,由于醋酸根结合部分氢离子,导致溶液中氢离子与氢氧根离子浓度不相等,水电离的氢离子、氢氧根总是相等的,故c(OH-)=c(CH3COOH)+c(H+),故C正确;
D.当 V=40 时,得到等浓度的CH3COONa、CH3COOH混合溶液,醋酸的电离程度大于CH3COO-的水解程度,溶液呈酸性,弱电解质电离程度不大,则溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故D错误.
故选:BC.
点评 本题考查离子浓度大小比较,关键是判断混合后溶液中溶质,再结合强弱电解质电离、盐类水解以及电荷守恒、微粒守恒、质子恒等式判断,注意在离子浓度等量关系判断中三大守恒的应用.

| A. | O | B. | F | C. | S | D. | Cl |
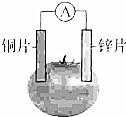 甲乙两位同学一起做水果电池的实验,测得数据如下:
甲乙两位同学一起做水果电池的实验,测得数据如下:| 试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑桔 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
①甲:实验6中负极电极反应式如何写?
乙:铝为负极:Al-3e-=Al3+
②甲:实验1、5中电流方向为什么相反?
乙:实验1中锌比铜活泼,锌为负极,实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关?
乙:只跟水果的品种有关.
| A. | ③ | B. | ① | C. | ①②③ | D. | ②③ |
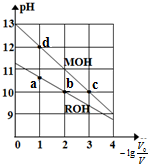 常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )
常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )| A. | b、c两点的溶液中:c(R+)>c(M+) | |
| B. | MOH的电离程度:c点小于d点 | |
| C. | 溶液中水的电离程度:b>c>a>d | |
| D. | 当-lg$\frac{{v}_{0}}{v}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
| A. | 用KSCN溶液鉴别FeCl2和FeCl3溶液 | |
| B. | 用澄清石灰水鉴别SO2和CO2 | |
| C. | 用焰色反应鉴别NaCl溶液和KCl洛液 | |
| D. | 用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液 |
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
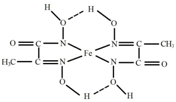 铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题:
铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题: