题目内容
4.强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
分析 稀的强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答.
解答 解:强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)十OH-(aq)=H2O△H=一57.3kJ/mol,
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l)△H=-Q3kJ•mol-1,
醋酸的电离吸热,浓硫酸溶于水放热,则放出的热量为Q2>Q3>Q1,
故选:C.
点评 本题考查中和热,明确中和热的概念及弱电解质的电离、浓硫酸溶于水的热效应即可解答,难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
15.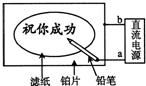 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H-1O$?_{充电}^{放电}$ 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
13.人工肾脏可用间接电化学方法除去代谢产物中的尿素[分子式为CO(NH2)2],原理如图所示.下列有关说法中错误的是( )

| A. | 电解结束后,阴极室溶液的pH与电解前相比将变大 | |
| B. | 若用铅蓄电池作该装置的供电电源,B接线柱应连接Pb | |
| C. | 涉及除去尿素的反应为CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl | |
| D. | 若通电一段时间后,电路中通过的电量是77.06×104C,则有8NA个H+通过质子交换膜 (一个电子所带的电量为1.6×10-19C) |
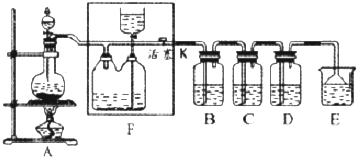

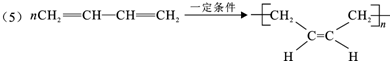 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.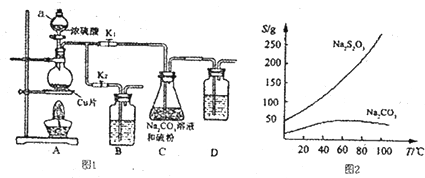



 2NH3.
2NH3.