题目内容
2.Ⅰ、(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是CA.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应式为H2+2OH--2e-=2H2O
Ⅱ、如图为相互串联的甲、乙两个电解池,请回答:
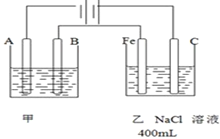
(3)甲池若为用电解原理精炼铜的装置,A极材料是纯铜,电极反应为Cu2++2e-=Cu,
(4)若甲槽阴极增重6.4g,则乙槽阴极放出气体在标准状况下的体积为2.24L.
(5)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为0.5mol/L.
分析 Ⅰ、(1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)氢氧燃料碱性电池中,负极上氢气失去电子;
Ⅱ、(3)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;
(4)甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算;
(5)依据析出铜的物质的量结合电子守恒计算生成的氢氧化钠的物质的量,来计算浓度.
解答 解:Ⅰ、(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O;
故答案为:H2+2OH--2e-=2H2O;
Ⅱ、(3)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;所以A极是阴极;材料是精铜;电极反应为:Cu2++2e-=Cu;B为阳极;材料是粗铜;电极反应主要为:Cu-2e-=Cu2+;电解质溶液是CuSO4溶液;
故答案为:阴极,Cu2++2e-=Cu;
(4)甲池是精炼铜,增重6.4g是铜的质量,物质的量为0.1mol,转移电子物质的量为0.2mol;根据电解反应过程中电极上的电子守恒计算可知;乙槽阳极电极反应为:2Cl--2e-=Cl2↑放出气体物质的量为0.1mol;在标准状况下的体积为2.24L;
故答案为:2.24;
(5)依据析出铜的物质的量为0.1mol,电子转移为0.2mol,结合电子守恒和水电离出的氢离子和氢氧根离子守恒计算生成的氢氧化钠的物质的量来计算浓度;电极反应为:2H++2e-=H2↑;减少氢离子物质的量为0.2mol,溶液中增多氢氧根离子物质的量为0.2mol,常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为0.5mol/L;
故答案为:0.5mol/L.
点评 本题考查原电池和电解池的原理分析和电极反应,明确原电池与氧化还原反应的关系及负极发生氧化反应,电解池中 电子守恒的计算是解答本题的关键,题目难度中等.

| A. | Na+、Mg2+、OH-、NO3- | B. | Al3+、NH4+、Br-、Cl- | ||
| C. | K+、HCO3-、Ca2+、SO42- | D. | Na+、K+、SiO32-、Cl- |
| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
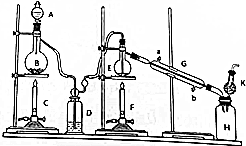
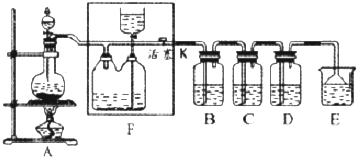
(1)A中浓盐酸与B中物质进行反应化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O
(2)D中的试剂为浓硫酸目的是干燥氯气,防止生成的四氯化锡发生水解反应
(3)G中冷却水的进水位置为b(填字母)
| A | B | C | D |
 | 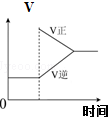 |  | 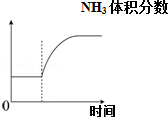 |
| 可逆反应:Cr2O72-+H2O?2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如图 | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42-(蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图 | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如图 | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图 |
| A. | A | B. | B | C. | C | D. | D |
(1)下列说法能说明上述反应向正反应方向进行的是bd(填序号).
a.单位时间内生成2a mol NH3的同时生成3a mol H2
b.单位时间内生成6a mol N-H键的同时生成2a mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:根据表中数据计算:
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
②根据计算可得m=0.6,0~2h内NH3的平均反应速率为0.15mol/(L•h),.
③此温度下反应:2NH3?N2+3H2的化学平衡常数K=6.75.
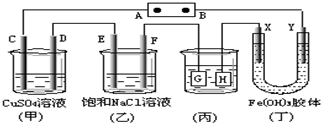 如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置乙中E极附近产生可燃气体 |

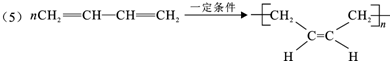 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.