题目内容
 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.(1)用0.1mol NaOH配成稀溶液与足量稀硝酸反应,能放出
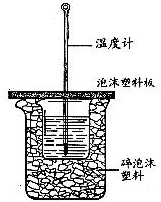
(2)如图装置中缺少的仪器名称是
(3)若通过实验测定中和热的△H,其结果常常大于-57.3kJ?mol-1,其原因可能是
(4)用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
考点:中和热的测定
专题:实验题
分析:(1)根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小;
(4)根据弱电解质电离吸热分析.
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小;
(4)根据弱电解质电离吸热分析.
解答:
解:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol NaOH配成稀溶液与足量稀硝酸反应可得0.molH2O,所以放出的热量为57.3kJ×0.1=5.73KJ,
故答案为:5.73KJ;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒,还缺少环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热作用,
故答案为:环形玻璃搅拌棒;保温、隔热作用;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,△H大于-57.3kJ?mol-1,
故答案为:实验过程中难免有热量散失;
(4)NH3?H2O为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小,故答案为:偏小.
故答案为:5.73KJ;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒,还缺少环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热作用,
故答案为:环形玻璃搅拌棒;保温、隔热作用;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,△H大于-57.3kJ?mol-1,
故答案为:实验过程中难免有热量散失;
(4)NH3?H2O为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小,故答案为:偏小.
点评:本题考查热化学方程式的计算以及测定反应热的误差分析,难度中等,注意理解中和热的概念.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
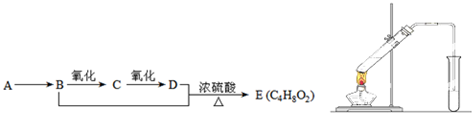
 2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.
2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.