题目内容
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3,Z元素只可以形成正一价离子.请回答下列问题:
(1)X元素的符号是
(2)Y元素原子的价电子排布图为
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是 .
(1)X元素的符号是
(2)Y元素原子的价电子排布图为
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;
Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;
X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为:42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;
X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为:42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
解答:
解:X的原子4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,
故X为As元素;Y为氧元素;Z为氢元素.
(1)由上述分析可知,X为As,故答案为:As;
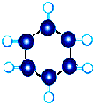
(2)Y元素原子的最外层2p轨道上有2个未成对电子,则元素原子基态时的电子排布式为1s22s22p4,为氧原子,其价电子的轨道表示式为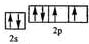 ,
,
故答案为: ;
;
(3)X为As元素、Y为氧元素,Z为氢元素.化合物X2Y3为As2O3,XZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,则反应方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
故X为As元素;Y为氧元素;Z为氢元素.
(1)由上述分析可知,X为As,故答案为:As;
(2)Y元素原子的最外层2p轨道上有2个未成对电子,则元素原子基态时的电子排布式为1s22s22p4,为氧原子,其价电子的轨道表示式为
 ,
,故答案为:
 ;
; (3)X为As元素、Y为氧元素,Z为氢元素.化合物X2Y3为As2O3,XZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,则反应方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O.
点评:本题考查结构与位置关系、核外电子排布规律、氧化还原反应、元素周期律等,难度中等,正确推断元素Y是解答关键,注意(2)中氧化还原反应方程式的书写配平.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B.将A氧化最终可得C,且B和C为同系物.若B可发生斐林反应,则原有机物的结构简式为( )
| A、HCOOCH2CH2CH3 |
| B、CH3COOCH2CH3 |
| C、CH3CH2COOCH3 |
| D、HOCH2CH2CH2CHO |
下列实验不能达到目的是( )
| A、向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 |
| B、只用少量水就可鉴别Na2CO3和NaHCO3固体 |
| C、用FeSO4、NaOH和盐酸等试剂在空气中可以制备纯净的FeCl3溶液 |
| D、用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
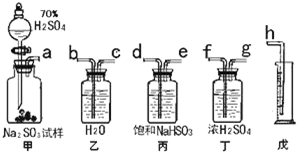 某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.