题目内容
1.某同学所做的有关铜元素的实验流程如图1:
(1)写出基态铜原子的价电子排布式3d104s1,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键类型有共价键、离子键、配位键.
(2)写出反应④的离子方程式Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;写出一种与SCN-互为等电子体的分子CO2(用化学式表示).
(4)氨基乙酸铜的分子结构如图2,碳原子的杂化方式为sp3、sp2.
(5)铜晶胞中,其晶体的堆积方式为面心立方最密堆积,一个晶胞中铜原子的数目为12,空间利用率为74%(写出计算过程)
分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子电子排布式;阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
(2)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键;异硫氰酸分子间可形成氢键,沸点较高;原子总数相同、价电子总数相同的微粒互为等电子体;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;
(5)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,利用均摊法计算Cu原子配位数;设Cu原子半径为d,利用均摊法计算晶胞中Cu原子数目,再计算晶胞中Cu原子总体积,晶胞棱长=4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2d}$d,可以计算晶胞体积,晶胞空间利用率=$\frac{原子总体积}{晶胞体积}$×100%.
解答 解:(1)Cu是29号元素,原子核外电子数为29,铜的基态原子价电子电子排布式3d104s1,;[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键;
故答案为:3d104s1;共价键、离子键、配位键;
(2)反应④是氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,离子反应方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键,(SCN)2分子含有5个σ键,故1mol(SCN)2分子中含有σ键的数目为 5NA,
由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,一种与SCN-互为等电子体的分子有CO2等,原子数相同,价电子数均为16,
故答案为:5NA;异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;CO2;
(4)氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化,
故答案为:sp3、sp2;
(5)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为$\frac{3×8}{2}$=12;
晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,设Cu原子半径为d,则Cu原子总体积为4×$\frac{4}{3}$πd3,晶胞棱长=4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2d}$d,晶胞体积为(2$\sqrt{2d}$)3,晶胞空间利用率=$\frac{4×\frac{4}{3}π{d}^{3}}{(2\sqrt{2d})^{3}}$×100%=74%,
故答案为:面心立方最密堆积;12;74%.
点评 本题是对物质结构的考查,涉及晶体结构与性质、核外电子排布、化学键、杂化轨道、晶胞计算等,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 混合气体密度恒定不变 | B. | 消耗n mol H2同时生成2n mol HI | ||
| C. | H2、I2、HI的浓度相等 | D. | 混合气体的颜色不再改变 |
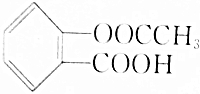 ]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
| A. | K+、Na+、Cl-、NO3- | B. | K+、Na+、Br-、SiO32- | ||
| C. | H+、Fe2+、SO42-、Cl2 | D. | K+、Ag+、NH3•H2O、NO3- |
| A. | c(OH-)=2.0×10-7mol•L-1 | B. | Kw=1×10-14 | ||
| C. | c(OH-)=1.0×10-14/2.0×10-7mol•L-1 | D. | 温度为25℃ |
| A. | SO32-、NO3-、Na+、K+ | B. | Na+、SO42-、Cl-、K+ | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、K+、AlO2-、SO42- |
 ,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.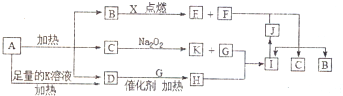
 ,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.