题目内容
4.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是( )| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
分析 表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数,由位置关系可知,X处于第二周期,Y、Z、W处于第三周期,则Y为Al,可推知T为Ga、Z为Si、W为P、X为N,结合元素周期律解答.
解答 解:表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数,由位置关系可知,X处于第二周期,Y、Z、W处于第三周期,则Y为Al,可推知T为Ga、Z为Si、W为P、X为N.
A.X、W、Z元素的原子半径依次递增,它们的气态氢化物的热稳定性依次递减,故A错误;
B.空气中含有大量的氮气,氮元素能以游离态存在,故B错误;
C.同主族自上而下金属性增强,故C正确;
D.W、Z的最高价对应的氧化物分别为五氧化二磷、二氧化硅,前者属于分子晶体,后者属于原子晶体,熔化时破坏的作用力不同,故D错误.
故选:C.
点评 本题考查元素周期表与元素周期律,从结构上理解同主族、同周期元素性质的相似性与递变性.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
14.重水(D2O)的主要作用是作为核反应堆的减速剂,下列说法正确的是( )
| A. | 氘(D)原子核外有2个电子 | B. | 1H与D互称同位素 | ||
| C. | H2与D2互称同素异形体 | D. | 18g D2O的物质的量为1mol |
15.某晶体中含有非极性键,关于该晶体的说法正确的是( )
| A. | 可能有很高的熔沸点 | B. | 不可能是化合物 | ||
| C. | 只可能是有机物 | D. | 不可能是离子晶体 |
19.下列有关溶液中离子存在和转化的表达合理的是( )
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
16. 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.下列有关化学用语表示正确的是( )
| A. | S2-的结构示意图: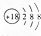 | |
| B. | 质子数为38,中子数为50的Sr原子:5038Sr | |
| C. | NH4Cl的电子式: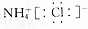 | |
| D. | PBr3的结构式: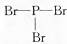 |
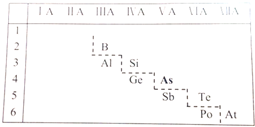
 ;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.
;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°. .
. .
.
