题目内容
13.由合成气制备乙醇一般有两种方法:(1)直接合成法
①2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1
②2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇.其生产流程如图所示:

③3CO(g)+3H2(g)?CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1
④CH3OCH3(g)+CO(g)?CH3COOCH3(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:

①反应①的△H1<0,△S<0.(填“>”、“<”或“=”)
②已知CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1,则△H1=-171.6kJ•mol-1.
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线.
(2)对反应③处于化学平衡状态时的描述,正确的是ABD.(填字母).
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是由于甲醇分子间脱水可生成二甲醚,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率.
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%.则氢气的反应速率v(H2)=1.5/t mol•L-1•min-1,平衡常数K=9.
分析 (1)由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;气体的体积减小,△S<0;
②利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的,根据目标方程改写分方程,然后求出反应热;
③在t1min时升温到600K,平衡逆向移动,从图1可知达平衡时H2O%大于40%小于45%,据此画出体系中水的体积分数在t1min后的变化曲线;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答;
(3)甲醇通过分子间脱水能生成二甲醚,能提高目标产物的产率;
(4)反应⑤为CH3COOCH3+2H2?CH3CH2OH+CH3OH,据此结合V=$\frac{△C}{△t}$计算氢气的反应速率,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值.
解答 解:(1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)正反应为气体的体积减小的反应,所以△S<0,
故答案为:<;<;
②Ⅰ2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1
Ⅱ2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
ⅢCO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1,将Ⅱ-Ⅲ×2得Ⅰ,所以△H1=(-253.6kJ•mol-1)-(-41kJ•mol-1)×2=-171.6kJ•mol-1,
故答案为:-171.6kJ•mol-1;
③2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1=-171.6kJ•mol-1,在t1min时升温到600K,平衡逆向移动,水的体积分数下降,从图1可知达平衡时H2O%大于40%小于45%,图象为: ,
,
故答案为: ;
;
(2)反应③3CO(g)+3H2(g)?CH3OCH3(g)+CO2 △H3=-260.2kJ•mol-1
A.化学反应达到平衡状态时,反应混合物中各组成成分的浓度不随时间改变,CO的含量保持不变,处于化学平衡状态,故A正确;
B.因间接合成法涉及③3CO(g)+3H2(g)?CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1④CH3OCH3(g)+CO(g)?CH3COOCH3(g),容器中CH3OCH3浓度与CO2浓度相等,处于化学平衡状态,故B正确;
C.3V正(CO)=V正(CH3OCH3) 表明正反应进行,反应没有停止,不能表明处于化学平衡状态,故C错误;
D.该反应正反应为放热反应,体系的温度保持不变,表明处于化学平衡状态,故D正确;
故答案为:ABD;
(3)甲醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成二甲醚,反应方程式为:2CH3OH $→_{140℃}^{浓硫酸}$CH3OCH3+H2O,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率,
故答案为:由于甲醇分子间脱水可生成二甲醚,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率;
(4)乙酸甲酯加氢得到乙醇.反应⑤为CH3COOCH3+2H2?CH3CH2OH+CH3OH,
CH3COOCH3+2H2?CH3CH2OH+CH3OH
起始(mol/L):1 2 0 0
转化(mol/L):0.75 1.5 0.75 0.75
平衡(mol/L):0.25 0.5 0.75 0.75
氢气的反应速率V(H2)=$\frac{△C}{△t}$=$\frac{1.5}{t}$mol•L-1•min-1
平衡常数K=$\frac{C(C{H}_{3}C{H}_{2}OH)×C(C{H}_{3}OH)}{C(C{H}_{3}COOC{H}_{3})×{C}^{2}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.{5}^{2}}$=9
故答案为:1.5/t mol•L-1•min-1;9.
点评 本题涉及热化学、化学反应速率和平衡的有关计算和判断知识,属于综合知识的考查题,注意化学平衡的三段式计算应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | VL amol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
| A. | 有机物 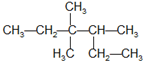 的系统命名为3,3-二甲基-2-乙基戊烷 的系统命名为3,3-二甲基-2-乙基戊烷 | |
| B. | 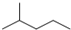 的一氯取代物的同分异构体有6种 的一氯取代物的同分异构体有6种 | |
| C. | 在相同条件下,等物质的量的乙烯和乙醇完全燃烧消耗的氧气体积相等 | |
| D. | 蔗糖、淀粉、纤维素、聚乙烯都属于高分子化合物 |
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA | |
| D. | 5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA |
| A. | 熔点较高,硬度较大 | B. | 易溶于水而难溶于有机溶剂 | ||
| C. | 固体时不能导电 | D. | 离子间距离较大,其密度较小 |
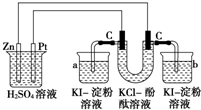 按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
 .
.