题目内容
14.下列有关化学用语表示正确的是( )| A. | S2-的结构示意图: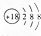 | |
| B. | 质子数为38,中子数为50的Sr原子:5038Sr | |
| C. | NH4Cl的电子式: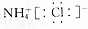 | |
| D. | PBr3的结构式: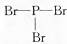 |
分析 A.硫离子的核电荷数为16,不是18;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.铵根离子为复杂阴离子,应该标出最外层电子;
D.中含有3个P-Br键,用短线代替所有的共用电子对己烷结构式.
解答 解:A.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故A错误;
,故A错误;
B.质子数为38,中子数为50的Sr原子的质量数为88,该原子正确的表示方法为:8838Sr,故B错误;
C.氯化铵是离子化合物,由氨根离子与氯离子构成,正确的电子式为 ,故C错误;
,故C错误;
D.PBr3中含有对P-Br共用电子对,其结构式为: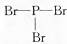 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及结构式、电子式、离子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
4.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是( )
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
5.设NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA | |
| D. | 5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA |
2.离子晶体一般不具有的特征是( )
| A. | 熔点较高,硬度较大 | B. | 易溶于水而难溶于有机溶剂 | ||
| C. | 固体时不能导电 | D. | 离子间距离较大,其密度较小 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO- | |
| B. | 与Al反应能放H2的溶液中:Na+、Cu2+、NO3-、I- | |
| C. | 0.1 mol•L-1Na2CO3溶液中:NH4+、K+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3- |
10. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(NH3)4】2+具有对称的空间构型.且当【E(NH3)4】2+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则【E(NH3)4】2+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式${N_A}=\frac{{\sqrt{2}×{{10}^{30}}M}}{{8{r^3}ρ}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多的 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(NH3)4】2+具有对称的空间构型.且当【E(NH3)4】2+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则【E(NH3)4】2+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式${N_A}=\frac{{\sqrt{2}×{{10}^{30}}M}}{{8{r^3}ρ}}$.(用M、r、ρ表示)

 .
.