题目内容
9.请回答:(1)NaOH的电子式为
 .
.(2)工业上常用焦炭还原二氧化硅制备粗硅,用化学方程式表示SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,有FeCO3白色沉淀生成和明显的无色气泡现象,写出相关离子方程式Fe2++2HCO3-=FeCO3+CO2↑+H2O.
(4)完成以下氧化还原反应的离子方程式:
(1) Cr2O2-7+(3) H2O2+(8)H+═(2) Cr3++(3)H2O+(7)H2O.
分析 (1)NaOH为离子化合物,钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键;
(2)焦炭高温还原二氧化硅生成一氧化碳和硅;
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液,则反应物为FeSO4、NH4HCO3,生成物为FeCO3、CO2、H2O,以此来解答;
(4)该反应中,其方程式为CrO42-是氧化剂,而过氧化氢是还原剂,根据得失电子和电荷守恒配平.
解答 解:(1)氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,
,
故答案为: ;
;
(2)焦炭高温还原二氧化硅生成一氧化碳和硅,化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液,则反应物为FeSO4、NH4HCO3,
生成物为FeCO3、CO2、H2O,该反应的离子方程式为Fe2++2HCO3-=FeCO3+CO2↑+H2O,
故答案为:Fe2++2HCO3-=FeCO3+CO2↑+H2O;
(4)该反应中,其方程式为CrO42-是氧化剂,而过氧化氢是还原剂,根据得失电子和电荷守恒配平得Cr2O72-+3H2O2+8H+═2Cr3++3O2↑+7H2O,
故答案为:1、3、8H+、2、3、7H2O.
点评 本题考查了离子方程式、化学方程式的书写,熟悉物质的性质及发生的化学反应是解题关键,题目难度不大,注意氧化还原反应的得失电子守恒.

练习册系列答案
相关题目
19.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 同温同压下,相同体积的氟气和氩气所含的原子数相等 | |
| B. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,1L 0.1 mol•L-1 CuSO4溶液中含有的Cu2+数目为0.1NA | |
| D. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
20.下列实验不能不能用如图所示装置实现的是( )
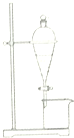

| A. | 用CCl4提取碘水中的碘 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用酒精除去苯酚中的甘油 | |
| D. | 用饱和Na2CO3溶液除去乙酸丁酯中的乙酸 |
17.分析生产生活中的下列过程,不涉及氧化还原反应的是( )
| A. | 煤液化制得清洁能源 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 从海水中提取氯化镁 |
4.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是( )
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
14.X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z 元素金属性最强,R原子的核外电子数是X、Z核外电子数之和.下列叙述一定正确的是( )
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | VL amol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
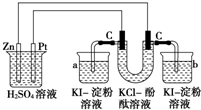 按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):