题目内容
14.重水(D2O)的主要作用是作为核反应堆的减速剂,下列说法正确的是( )| A. | 氘(D)原子核外有2个电子 | B. | 1H与D互称同位素 | ||
| C. | H2与D2互称同素异形体 | D. | 18g D2O的物质的量为1mol |
分析 A.重氢原子的核电荷数为1;
B.具有相同质子数,不同中子数的同一元素的不同核素互为同位素;
C.由同种元素形成的不同种单质互为同素异形体;
D. D2O的摩尔质量为20g/mol.
解答 解:A.核电荷数=质子数=核外电子数,重氢原子的核电荷数为1,故重氢原子核外有1个电子,故A错误;
B.1H与D具有相同质子数,不同中子数,互称同位素,故B正确;
C.H2与D2是同种单质,故C错误;
D.D2O的摩尔质量为20g/mol,18g D2O的物质的量小于1mol,故D错误.
故选B.
点评 本题考查原子构成、核素、同位素以及同素异形体等知识,注意同位素和同素异形体的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列各组物质中互为同分异构体的是( )
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甲酸甲酯(HCOOCH3)和乙酸(CH3COOH) | D. | 淀粉和纤维素 |
2.下列说法中错误的是( )
| A. | “液氯”是纯净物而“氯水”是混合物 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | NO2溶于水发生了氧化反应,它既是氧化剂又是还原剂 | |
| D. | 用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近,能看到白烟 |
19.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 同温同压下,相同体积的氟气和氩气所含的原子数相等 | |
| B. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,1L 0.1 mol•L-1 CuSO4溶液中含有的Cu2+数目为0.1NA | |
| D. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
4.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是( )
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |

 ;
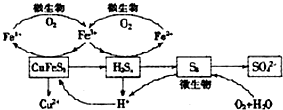
; 在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.
在如图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体.
 ②
②
 .
.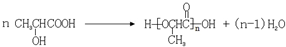 .
.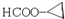 .
.