题目内容
16. 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
分析 分子中氢原子的种类等于一氯取代物的种类,据此解答.
解答 解:该分子不对称, 分子中7种氢原子,一氯代物有7种.
分子中7种氢原子,一氯代物有7种.
故选B.
点评 本题考查一氯代物的书写,题目难度不大,正确判断等效氢原子数目为解答本题的关键.

练习册系列答案
相关题目
7.对离子方程式2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O的分析,正确的是( )
| A. | 可以表示:Ca(HCO3)2溶液与Ca(OH)2溶液的反应 | |
| B. | 不能表示:Ca(HCO3)2溶液与Ba(OH)2溶液反应 | |
| C. | 可以表示:Ca(HCO3)2溶液与NaOH溶液反应 | |
| D. | 不能表示:NaHCO3溶液与Ca(OH)2溶液反应 |
4.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数为其族序数.下列说法正确的是( )
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 在10g质量分数为46%的乙醇水溶液中含有H原子数目为1.2NA | |
| B. | 标准状况下22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| C. | 4.0gH2与足量O2完全反应生成水,反应中断裂共价键数目为2NA | |
| D. | 常温常压下,将0.1molFe投入足量浓硝酸中,转移电子数为0.3NA |
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | VL amol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
8.下列说法正确的是( )
| A. | 有机物 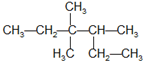 的系统命名为3,3-二甲基-2-乙基戊烷 的系统命名为3,3-二甲基-2-乙基戊烷 | |
| B. | 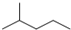 的一氯取代物的同分异构体有6种 的一氯取代物的同分异构体有6种 | |
| C. | 在相同条件下,等物质的量的乙烯和乙醇完全燃烧消耗的氧气体积相等 | |
| D. | 蔗糖、淀粉、纤维素、聚乙烯都属于高分子化合物 |
5.设NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA | |
| D. | 5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO- | |
| B. | 与Al反应能放H2的溶液中:Na+、Cu2+、NO3-、I- | |
| C. | 0.1 mol•L-1Na2CO3溶液中:NH4+、K+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3- |

 ②
②
 .
.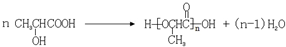 .
.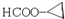 .
.