题目内容
18.工业上用铝土矿(主要成分为Al203,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )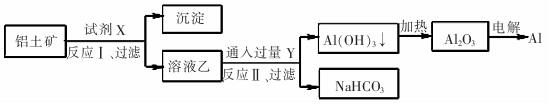
| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+AlO2-+2H20=Al(OH)3↓+HCO3一 | |
| C. | 结合质子( H+)的能力由强到弱的顺序是Al02->CO32->OH- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AICl3冶炼Al |
分析 由工艺流程图可知,试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①过滤后所得溶液乙为NaAlO2溶液,沉淀为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤后分离后,加热分解Al(OH)3↓生成Al2O3,电解熔融Al2O3属于氧化还原反应,以此解答该题.
解答 解:A.分离氧化铝和氧化铁,只能用氢氧化钠溶液,不可能用酸,因氧化铝与氢氧化钠反应,氧化铁不反应,但二者都可与酸反应,故A错误;
B.铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C.结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C错误;
D.Al活泼性较强,氯化铝是共价化合物,所以工业上还可采用电解熔融Al2O3,故D错误.
故选B.
点评 本题以铁、铝化合物的性质为载体综合考查工业冶炼铝等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,难度中等.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
9.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )

| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-) |
6.实验室从含氯化钠、硝酸钾混合液中提取KNO3的过程如图所示.下列分析正确的是( )


| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
3.制备硅单质时,主要化学反应如下:
(1)SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO
(2)Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$ Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
(1)SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO
(2)Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$ Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
| A. | (1)(3)为置换反应 | B. | (1)(2)(3)均为氧化还原反应 | ||
| C. | (2)为化合反应 | D. | 反应物中硅元素均被还原 |
10.如图所示的实验,能达到实验目的或说法正确的是( )
| A. | 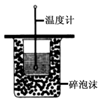 进行中和热的测定 | |
| B. | 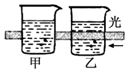 运用该实验可区分胶体和溶液 | |
| C. | 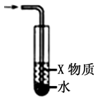 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
8.下列叙述中不正确的是( )
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO-2、SO2-4 | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 镍镉可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2$?_{放电}^{充电}$Cd(OH)2+2Ni(OH)2+2H2O,充电时阳极反应为:Ni(OH)2+OH-+e-═NiO(OH)+H2O | |
| D. | 某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O.已知As是产物之一,则该反应配平后H2O的化学计量数为6 |