题目内容
8.经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题: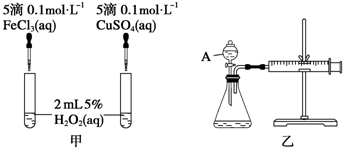
(1)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.写出H2O2在二氧化锰催化作用下发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
分析 (1)根据反应生成气体的快慢分析;H2O2在二氧化锰催化作用下发生反应生成水和氧气;
(2)根据实验仪器的特点来判断,该反应是通过反应速率分析的,可以根据v=$\frac{△V}{△t}$判断.
解答 (1)该反应中产生气体,所以可根据生成气泡的快慢判断,H2O2在二氧化锰催化作用下发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:反应产生气泡的快慢;2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(2)图中仪器A的名称为分液漏斗,该反应是通过生成气体的反应速率分析判断的,所以根据v=$\frac{△V}{△t}$知,需要测量的数据是产生40ml气体所需要的时间,故答案为:分液漏斗;收集40 mL气体所需要的时间.
点评 本题考查了催化剂的作用及化学反应速率的影响因素等知识点,难度不大,注意知识的灵活应用是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ②③⑤⑦ | B. | ②⑥⑦ | C. | ②④⑤⑥⑦ | D. | ②④⑥ |
16.如图为铜铁原电池示意图,下列有关说法正确的是( )
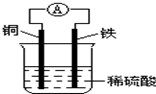

| A. | 铜棒逐渐溶解 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 负极反应式为Fe-2e-=Fe2+,发生还原反应 | |
| D. | 电子由铁棒通过导线流向铜棒 |
3.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )
| A. | A电极上发生的电极反应是还原反应 | |
| B. | A的金属性强于B | |
| C. | 电子不断由A电极经外电路流向B电极 | |
| D. | 溶液中的阳离子移向负极 |
13.已知:含碳碳双键的物质一定条件下能与水发生加成反应生成醇,有机物A-D间存在图示的转化关系.下列说法不正确的是( )
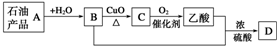

| A. | A能使酸性高锰酸钾溶液褪色 | B. | 可用B萃取碘水中的碘单质 | ||
| C. | B与乙酸发生了取代反应 | D. | D的结构简式为CH3COOCH2CH3 |
17.下列有关实验的叙述对应关系不正确的是( )
| 选项 | A | B | C | D |
| 装 置 图 |  | 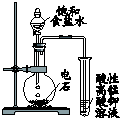 | 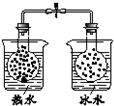 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
 ,
,
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯: