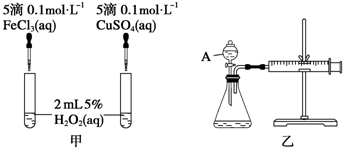
题目内容
13.已知:含碳碳双键的物质一定条件下能与水发生加成反应生成醇,有机物A-D间存在图示的转化关系.下列说法不正确的是( )
| A. | A能使酸性高锰酸钾溶液褪色 | B. | 可用B萃取碘水中的碘单质 | ||
| C. | B与乙酸发生了取代反应 | D. | D的结构简式为CH3COOCH2CH3 |
分析 A和水反应生成B,B能发生氧化反应生成C,C发生催化氧化生成乙酸,则C为CH3CHO、B为CH3CH2OH、A为
CH2=CH2,在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成D,D为CH3COOCH2CH3,结合题目分析解答.
解答 解:A和水反应生成B,B能发生氧化反应生成C,C发生催化氧化生成乙酸,则C为CH3CHO、B为CH3CH2OH、A为CH2=CH2,在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成D,D为CH3COOCH2CH3,
A.A为乙烯,乙烯中含有碳碳双键,性质较活泼,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A正确;
B.B为乙醇,乙醇和水互溶,所以乙醇不能萃取碘水中的碘,故B错误;
C.乙醇和乙酸的酯化反应也属于取代反应,故C正确;
D.通过以上分析知,D结构简式为CH3COOCH2CH3,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确烯烃、醇、醛、羧酸、酯之间的相互转化是解本题关键,熟悉常见官能团及其性质,题目难度不大.

练习册系列答案
相关题目
3.总质量一定的两种气态烃组成的混合物,无论以何种体积比混合,完全燃烧生成CO2的质量都一定,则此两种烃一定满足( )
| A. | 互为同分异构体 | B. | 最简式相同 | ||
| C. | 互为为同系物 | D. | 每个烃分子含相同数目的碳原子 |
4. 部分难溶物的颜色和常温下的Ksp如下表所示:
部分难溶物的颜色和常温下的Ksp如下表所示:
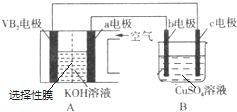
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图1所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图2所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
 部分难溶物的颜色和常温下的Ksp如下表所示:
部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
实验Ⅰ装置如图1所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图2所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
1.下列反应条件的控制中不恰当的是( )
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快H2O2的分解速率,把反应容器放到冷水中冷却 | |
| D. | 为加快KClO3的分解速率,加入MnO2 |
18.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+) |