题目内容
18.现有三组溶液,分离各混合液的正确方法依次是①汽油和氯化钠溶液分液
②39%的乙醇溶液蒸馏
⑧氯化钠和单质碘的水溶液萃取.
分析 ①汽油和氯化钠溶液分层;
②39%的酒精溶液,混合物互溶,沸点不同;
③溴不易溶于水,易溶于有机溶剂.
解答 解:①汽油和氯化钠溶液分层,选择分液法分离,故答案为:分液;
②39%的酒精溶液,混合物互溶,沸点不同,则选择蒸馏法分离,故答案为:蒸馏;
③溴不易溶于水,易溶于有机溶剂,则选择萃取法分离,故答案为:萃取.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意分离方法的选择,题目难度不大.

练习册系列答案
相关题目
10.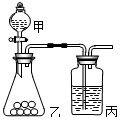 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
(1)实验①②表明同周期元素从左往右金属性逐渐减小(填“增大”、“减小”或“不变”).
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过),分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
9. 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )| A. | 在正极发生的电极反应为:AgO+2e-+H2O=Ag+2OH- | |
| B. | 在正极区H+浓度增大,在负极区H+浓度减少 | |
| C. | 该电池总反应的化学方程式:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O | |
| D. | 当电池负极的质量变化10.8g,则过程中电池流动的电子物质的量为1.2NA |
6.下列各反应中,生成物不随反应条件或反应物的用量变化而变化的是( )
| A. | 铁丝和氯气 | B. | NaOH和CO2 | C. | Fe和稀HNO3 | D. | Na和O2 |
13.200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g.则原混合气体中CO2和H2O的物质的量之比是( )
| A. | 1:4 | B. | 3:11 | C. | 1:11 | D. | 21:22 |
3. 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )| A. | 正反应放热,L是固体 | B. | 正反应放热,L是气体 | ||
| C. | 正反应吸热,L是气体 | D. | 正反应吸热,L是固体 |
10.下列物质中,只含有离子键而不含有共价键的是( )
| A. | Na2O2 | B. | CaCL2 | C. | 氮气 | D. | CCL4 |
7.列表示对应化学反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
8.下列有机物的命名正确的是( )
| A. |  二溴乙烷 二溴乙烷 | B. |  3乙基1丁烯 3乙基1丁烯 | ||
| C. |  2甲基2,4己二烯 2甲基2,4己二烯 | D. |  2,4,4三甲基戊烷 2,4,4三甲基戊烷 |