题目内容
13.200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g.则原混合气体中CO2和H2O的物质的量之比是( )| A. | 1:4 | B. | 3:11 | C. | 1:11 | D. | 21:22 |
分析 200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=$\frac{m}{M}$计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),令混合物中CO2和水蒸气的物质的量分别为为xmol,ymol,根据生成氧气的物质的量及二者之和,列方程计算.
解答 解:向足量的固体Na2O2中通入11.6gCO2和H2O,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=0.25mol,
令混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则:
2Na2O2+2CO2=2Na2CO3+O2,
x 0.5x
2Na2O2+2H2O=4NaOH+O2↑
ymol 0.5ymol
所以$\left\{\begin{array}{l}{0.5x+0.5y=0.25}\\{44x+18y=11.6}\end{array}\right.$
解得:x=0.1mol,y=0.4mol,所以原混合气体中CO2和H2O的物质的量之比是1:4,故选A.
点评 本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 常温下,0.1L 0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA | |
| B. | 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 100g KHCO3和CaCO3的混合物,含有的阳离子数目为NA |
1.下列说法正确的是( )
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| D. | 结构简式为 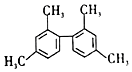 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
8.下列物质与常用危险化学品的类别不对应的是( )
| A. | 浓H2SO4、NaOH--腐蚀品 | B. | 酒精--易燃气体 | ||
| C. | KMnO4--氧化剂 | D. | 甲烷--易燃气体 |
5.在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-.在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种.关于此溶液,下列说法正确的是( )
| A. | 原溶液中可能含有SiO32- | |
| B. | 生成的气体中一定有NO,可能含有CO2 | |
| C. | 溶液中减少的离子是SO32-、I-、NO3- | |
| D. | 原溶液中一定含有SO42- |
2.其他条件不变,下列数据随温度升高的变化趋势一定正确的是( )
| A. | 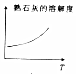 | B. |  | C. | 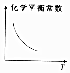 | D. | 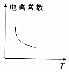 |
3.下列关于NO2的说法正确的是( )
| A. | NO2 是无色气体 | |
| B. | NO2 能用排水气法收集 | |
| C. | NO2能与水反应,在反应中氮元素的化合价不发生变化 | |
| D. | NO2能与水反应,在反应中NO2既是氧化剂,又是还原剂 |