题目内容
10.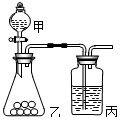 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过),分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
分析 (1)金属性越强,与酸反应越剧烈;
(2)比较氯与硫的非金属性,丙中发生氯气与硫化钠的反应,前面的装置制备氯气;
(3)由实验②可知金属的活泼性不同;
(4)控制其他因素相同,只有浓度一个变量.
解答 解:(1)钠与水反应剧烈,Mg与盐酸反应比Al与盐酸反应剧烈,则实验①②表明同周期元素从左往右金属性逐渐减小,故答案为:减小;
(2)比较氯与硫的非金属性,丙中发生氯气与硫化钠的反应,前面的装置制备氯气,则甲、乙所装药品分别为浓盐酸、硫化钠溶液,装置丙中实验现象为有淡黄色沉淀生成,离子方程式为 S2-+Cl2=2Cl-+S↓,故答案为:浓盐酸;硫化钠溶液;S2-+Cl2=2Cl-+S↓;
(3)由实验②可知金属的活泼性不同,则由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质,
故答案为:反应物本身的性质;
(4)证明浓度对反应速率的影响的实验为在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应,
故答案为:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
点评 本题考查反应速率的实验探究,为高频考点,把握金属性质、浓度对反应速率的影响、控制变量法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列元素位于d区的是( )
| A. | C | B. | Ca | C. | Cr | D. | Ga |
1.已知:25℃时,电离常数Kb(NH3•H2O)=1.8×10-5,CH3COOH的电离常数与其相等.现向1L 0.1mol•L-1氨水中加入等体积的0.1mol•L-1CH3COOH溶液,则下列说法正确的是( )
| A. | 在滴加过程中,Kw始终保持不变 | |
| B. | 25℃时,反应后溶液中c(NH4+)>c(CH3COO-) | |
| C. | 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂 | |
| D. | 25℃时,反应NH4++H2O?NH3•H2O+H+的平衡常数约为5.6×10-10 |
18.某阳离子为钠离子的溶液中,可能含有SO42-、CO32-、Cl-的一种或几种,只取原溶液一次,便能一一检验其中存在的阴离子.下列加入试剂的顺序最合理的是( )
| A. | HNO3、Ba(NO3)2、AgNO3 | B. | Ba(NO3)2、AgNO3、HNO3 | ||
| C. | 酚酞、Ba(NO3)2、AgNO3 | D. | HCl、BaCl2、AgNO3 |
5.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 常温下,0.1L 0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA | |
| B. | 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 100g KHCO3和CaCO3的混合物,含有的阳离子数目为NA |
15.(CH3)2C(C2H5)CH(CH3)2的名称是( )
| A. | 2,3,3-三甲基戊烷 | B. | 3,3,4-三甲基戊烷 | ||
| C. | 2,3-二甲基-2-乙基丁烷 | D. | 2,3-二甲基-3-乙基丁烷 |
2.下列关于石油的说法正确的是( )
| A. | 石油属于可再生矿物能源 | B. | 石油主要含有碳、氢两种元素 | ||
| C. | 石油裂化属于物理变化 | D. | 石油分馏属于化学变化 |
19.下列物质的性质和应用相对应的是( )
| 化学性质 | 实际应用 | |
| A | SiCl4与水反应时生成白色烟雾 | SiCl4在战争中可用作烟雾弹 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | MgO是一种电解质 | 工业电解冶炼金属镁 |
| D | 铝耐腐蚀 | 用铝质容器研制咸菜 |
| A. | A | B. | B | C. | C | D. | D |