题目内容
14.如图是两种溶液进行电解的装置,电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B、C、D都是铂电极,P、Q是电池的两极,电路接通后,试回答下列问题:
(1)电极B上金属M沉淀出来:B电极反应为M2++2e-═M,A极上电极反应为M-2e-═M2+,电极C电极反应为4OH--4e-═2H2O+O2↑,电极D电极反应为4H++4e-=2H2↑.
(2)电池中P是正 极,Q是负极.
分析 电路接通后,M沉积于电极B上,说明B电极上得电子发生还原反应,所以B极是电解池的阴极,A极阳极,P是电源的正极,Q是电源的负极;A电极上金属失电子发生氧化反应;C电极是阳极,D是阴极,工作时,C电极上氢氧根离子放电生成氧气,D电极上氢离子放电生成氢气,据此分析.
解答 解:(1)电路接通后,M沉积于电极B上,说明B电极上得电子发生还原反应,电极反应式为M2++2e-=M,A电极上金属M失电子生成金属阳离子而发生氧化反应,电极反应式为M-2e-═M2+,C电极是阳极,D是阴极,工作时,C电极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=2H2O+O2↑,D电极上氢离子放电生成氢气,电极反应式为4H++4e-=2H2↑,
故答案为:M2++2e-=M;M-2e-═M2+;4OH--4e-=2H2O+O2↑;4H++4e-=2H2↑;
(2)电路接通后,M沉积于电极B上,说明B电极上得电子发生还原反应,所以B极是电解池的阴极,A极阳极,P是电源的正极,Q是电源的负极,
故答案为:正;负.
点评 本题考查了电解原理,明确各个电极上放电的微粒是解本题关键,注意活泼金属作电解池阳极时,阳极上金属失电子发生氧化反应而不是电解质溶液中阴离子放电,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
19.与100mL0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
6.下列说法不正确的是( )
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
20.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一.回答下列问题:
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
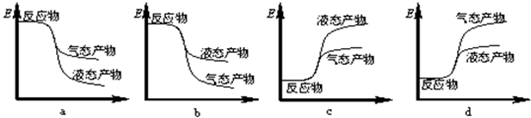
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.下列表示该反应的能量变化的示意图中正确的是a(填字母代号).
②合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH2OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如表所示(前6min没有改变条件):
①x=0.14,250℃时该反应的平衡常数K=46.3.
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)甲醇在原电池上的使用,提高了燃料的利用效率,达到节能减排的目的.若用熔融的Na2CO3使作电解质、氧气作助燃剂组成的燃料电池,写出负极的电极反应式:2CH3OH-12e-+6CO32-=8CO2+4H2O.
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.下列表示该反应的能量变化的示意图中正确的是a(填字母代号).

②合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH2OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)甲醇在原电池上的使用,提高了燃料的利用效率,达到节能减排的目的.若用熔融的Na2CO3使作电解质、氧气作助燃剂组成的燃料电池,写出负极的电极反应式:2CH3OH-12e-+6CO32-=8CO2+4H2O.
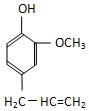 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答: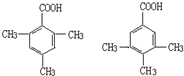 中的一种.
中的一种. 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH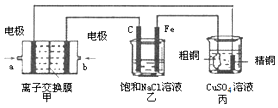
 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.