题目内容
18.用20g氢氧化钠配成250mL溶液,其物质的量浓度为2mol/L;从中取出5mL溶液,加水稀释为100mL,则稀释后溶液的物质的量浓度为0.1mol/L,在这100mL溶液中含NaOH的质量为0.4g.分析 根据c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$计算物质的量浓度;溶液稀释前后溶质的物质的量不变,据此计算稀释后溶液物质的量浓度;根据m=cVM计算溶质的质量.
解答 解:c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{\frac{20g}{40g/mol}}{0.25L}$=2mol/L,溶液稀释前后溶质的物质的量不变,则稀释后溶液物质的量浓度=$\frac{2mol/L×0.005L}{0.1L}$=0.1mol/L,这100mL溶液中溶质的质量=0.1mol/L×0.1L×40g/mol=0.4g,
故答案为:2 mol•L-1;0.1mol•L-1;0.4g.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,熟练掌握物质的量有关公式,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.下列说法不正确的是( )
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
13.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | lmolAl3+离子含有的电子数为3NA | |
| B. | 7lgCl2约含有6.02×1023个筑原子 | |
| C. | 58.5g氯化钠固体中,含1 NA个阴离子 | |
| D. | 欲配制1.00L l.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
10.下列反应既属于氧化还原反应又符合图示能量变化的是( )
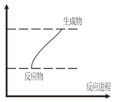

| A. | 灼热的炭与CO2的反应 | B. | 铝片与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O和NH4Cl的反应 | D. | 甲烷在氧气中的燃烧反应 |
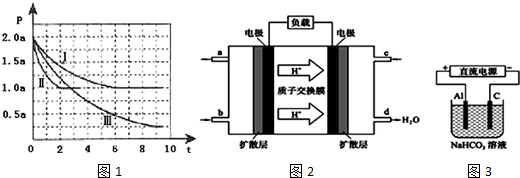
 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.