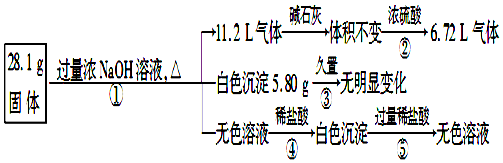
题目内容
18.Ⅰ.氮的固定是几百年来科学家一直研究的课题.(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
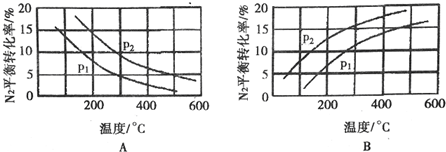
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:p2>pl.
Ⅱ. 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)
(3)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=60%.
②已知平衡时,容器压强为8MPa,则平衡常数Kp=0.26 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
分析 Ⅰ.(1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
Ⅱ.(3)①设平衡时有x molN2转化,计算出转化的氮气的物质的量,再计算出氮气的转化率;
②利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2})•{P}^{3}({H}_{2})}$.
解答 解:Ⅰ.(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,
故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大,р2>р1,
故答案为:A;р2>р1;
Ⅱ. (3)①设平衡时有x molN2转化,
N2(g)+3H2(g)?2NH3(g)
起始物质的量:1mol 3mol 0
变化的物质的量:x 3x 2x
平衡物质的量:1-x 3-3x 2x
列式可得:(1-x)+(3-3x)+2x=2.8,
解得x=0.6mol,α1 =$\frac{3×0.6}{3}$×100%=60%,
故答案为:60%;
②平衡时各物质的压强之比等于其物质的量之比,所以P(N2)=$\frac{(1-0.6)mol}{2.8mol}$×8MPa=$\frac{8}{7}$MPa,
P(H2)=$\frac{3×(1-0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,P(NH3)=$\frac{(2×0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,
化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2})•{P}^{3}({H}_{2})}$=$\frac{(\frac{24}{7})^{2}}{\frac{8}{7}×(\frac{24}{7})^{3}}$≈0.26,
故答案为:0.26.
点评 本题考查了化学平衡计算、影响化学平衡的因素等,题目难度中等,侧重于考查学生分析判断及计算能力,注意三段式在化学平衡计算中的灵活应用,难点是用平衡分压代替平衡浓度计算.

| A. | NH3•H2O的电离度 | B. | c(H+) | C. | 电离平衡常数K碱 | D. | c(NH4+) |
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 实验室金属钠着火,立即用水浇灭 |
 B.
B.
 D.
D.
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题: