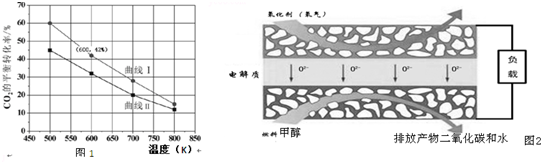
题目内容
3.若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应N2(g)+3H2(g)?2ΝΗ3(g)△H=-92.4kJ/mol①该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
②若在5分钟时反应达到平衡,此时测得NH3的物质的量为 0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).
③根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越小.
④能说明该反应达到化学平衡状态的是ad(填字母).
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变.
分析 ①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②根据v=$\frac{△c}{△t}$计算v(NH3),再根据反应速率之比等于系数之比计算v(N2);
③反应是放热反应,升高温度后平衡逆向进行,平衡常数减小;
④根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;
②5min达平衡,△c(NH3)=0.1mol/L,所以v(NH3)=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),根据反应速率之比等于系数之比,则v(N2)=$\frac{1}{2}$×0.02mol/(L•min)=0.01mol/(L•min),
故答案为:0.01mol/(L•min);
③该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
④a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;
b.该反应为反应前后体积不等的反应,则容器内压强保持不变,能判断达到平衡,故b正确;
c.υ正(N2)=2υ逆(NH3),正、逆反应速率不等,不能判断平衡,故c错误;
d.混合气体中 c(NH3)不变,为平衡的特征,能判断达到平衡,故d正确;
故选ad.
点评 本题考查较综合,涉及化学反应速率计算、化学平衡常数、化学平衡的判定等,注意化学平衡判定选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,题目难度中等.

| 组号 | 反应温度 /℃ | 参加反应物质 | ||||
| KMnO4 | H2C2O4 | MnSO4 | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | m/g | ||
| A | 20 | 4 | 0.1 | 2 | 0.1 | 0 |
| B | 20 | 4 | 0.1 | 2 | 0.1 | 0.1 |
| C | 40 | 4 | 0.1 | 2 | 0.1 | 0 |
| D | 40 | 4 | 0.1 | 2 | 0.2 | 0.1 |
| A. | A | B. | B | C. | C | D. | D |
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
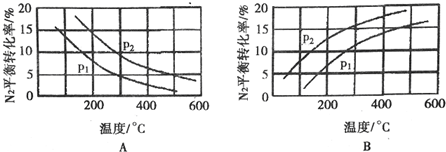
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:p2>pl.
Ⅱ. 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)
(3)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=60%.
②已知平衡时,容器压强为8MPa,则平衡常数Kp=0.26 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
| A. | 酒精挥发 | B. | 干冰升华 | C. | 铁钉生锈 | D. | 石蜡融化 |
| A. | $\frac{71ρ}{32}$g•L-1 | B. | $\frac{32ρ}{71}$g•L-1 | C. | $\frac{32}{71ρ}$g•L-1 | D. | $\frac{71}{32ρ}$g•L-1 |
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
 B.
B.  C.
C.  D.
D.