题目内容
6.下列说法正确的是( )| A. | 同时改变两个变量来研究化学平衡的移动,能更快得出有关规律 | |
| B. | 催化剂通过改变反应历程,降低反应的活化能来加快反应速率 | |
| C. | 可逆反应的平衡向正向移动,该反应的平衡常数一定增大 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
分析 A.同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律;
B.催化剂可降低反应的活化能;
C.温度不变,则平衡常数不变;
D.安装煤炭燃烧过程的“固硫”装置,可减少环境污染.
解答 解:A.同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律,应改变一个变量,故A错误;
B.催化剂可降低反应的活化能,增大活化分数百分数,增大反应速率,故B正确;
C.温度不变,则平衡常数不变,故C错误;
D.安装煤炭燃烧过程的“固硫”装置,可减少二氧化硫,以免造成环境污染,故D错误.
故选B.
点评 本题考查较为综合,涉及化学反应速率、化学平衡移动的影响,为高频考点,侧重于学生的分析能力的考查,注意把握影响平衡移动的因素,难度不大.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
7. 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
17.(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图1所示:
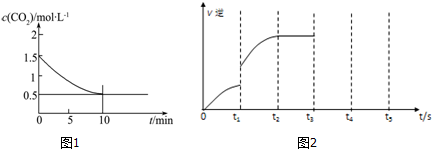
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2.
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是AC.
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线.
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图1所示:

①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2.
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是AC.
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线.
1.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
18.下列化学用语表述正确的是( )
| A. | 过氧化氢电子式: | B. | F-的结构示意图: | ||
| C. | 邻羟基苯甲酸的结构简式: | D. | 中子数为28的钙原子:${\;}_{20}^{28}$Ca |
15.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 28gMgCO3和NaHCO3混合固体中的CO32-离子数为NA | |
| B. | lmolI2与4molH2反应生成的HI分子数为2NA | |
| C. | 1molAl溶于含1molNaOH溶液,电子转移数为3NA | |
| D. | 标准状况下,2.24LH2O含有的共价键数为0.2NA |
16.化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是( )
| A. | 墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞 | |
| B. | 持续加热到一定温度能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 洁厕液与84消毒液混合洗厕所可以达到洗涤和消毒杀菌的双重功效,对人体不可能造成伤害 | |
| D. | 用13C示踪原子法可以进行幽门螺旋杆菌的精确检测 |