题目内容
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
分析 A、求出20gH218O的物质的量,然后根据H218O中含10个中子来分析;
B、求出乙烷的物质的量,然后根据乙烷中含6条极性键来分析;
C、pH=3的醋酸溶液中,氢离子浓度为0.001mol/L;
D、根据稀硝酸和铁的反应方程式为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O来分析.
解答 解:A、20gH218O的物质的量为1mol,而H218O中含10个中子,故1molH218O中含有10NA个中子,故A错误;
B、标况下11.2L乙烷的物质的量为0.5mol,而乙烷中含6条极性键,故0.5mol乙烷中含3NA条极性键,故B错误;
C、pH=3的醋酸溶液中,氢离子浓度为0.001mol/L,故1L溶液中含有的氢离子的个数为0.001NA个,故C错误;
D、根据稀硝酸和铁的反应方程式为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O可知,8mol硝酸~6mol电子,设1mol硝酸转移的电子的物质的量为xmol,则有:$\frac{8}{1}=\frac{6}{x}$,解得x=0.75mol,即0.75NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
12.下列实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向酸性KMnO4溶液中滴加H2O2溶液至过量 | 紫色消失 | H2O2在该反应中作还原剂 |
| B | 溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀生成 | X一定是Cl2 |
| C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置 | 有机相呈红棕色,水相呈无色 | Fe2+的还原性大于Br- |
| D | 铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中 | 铝丝表面变红色 | 铝可从铜盐溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
19.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1L 0.1mol•L-1 NaAlO2溶液中AlO2-数为0.1NA | |
| B. | 4.48L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 1.2g金刚石所含共价键数为0.2NA | |
| D. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
6.下列说法正确的是( )
| A. | 同时改变两个变量来研究化学平衡的移动,能更快得出有关规律 | |
| B. | 催化剂通过改变反应历程,降低反应的活化能来加快反应速率 | |
| C. | 可逆反应的平衡向正向移动,该反应的平衡常数一定增大 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
16.下列实验中根据现象得出的结论错误的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是SO3气体 |
| B | 向某溶液中加入Cu 和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO3- |
| C | 将Na投到一定浓度的CuCl2溶液 | 出现气泡并有固体生成 | Na与CuCl2溶液反应,有H2和Cu生成 |
| D | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
3.利用自然资源制备相关化学物质,下列化工生产不可行的是( )
| A. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| B. | 石英砂$→_{高温}^{焦炭}$粗硅$\stackrel{Cl_{2}}{→}$粗SiCl4$→_{(2)H_{2}/高温}^{(1)分馏提纯}$高纯硅 | |
| C. | 提取食盐后的母液$\stackrel{Cl_{2}}{→}$含Br2的液体$\stackrel{热空气}{→}$$\stackrel{冷凝}{→}$粗Br2$→_{蒸馏}^{NaBr(s)}$Br2 | |
| D. | 铝土矿$→_{(2)过滤}^{(1)NaOH(aq)}$NaAlO2(aq)$→_{(2)过滤}^{(1)CO_{2}}$Al(OH)3$\stackrel{煅烧}{→}$Al2O3$→_{电解}^{煅烧}$Al |
1.近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
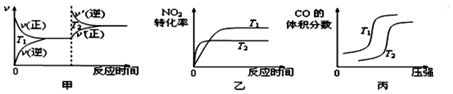
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=0.030mol•L-1•min-1;计算该反应的平衡常数K=0.56.
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是CD(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a<0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
下列说法正确的是CD
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是CD(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a<0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.