题目内容
18.下列化学用语表述正确的是( )| A. | 过氧化氢电子式: | B. | F-的结构示意图: | ||
| C. | 邻羟基苯甲酸的结构简式: | D. | 中子数为28的钙原子:${\;}_{20}^{28}$Ca |
分析 A.过氧化氢是共价化合物,不存在阴阳离子;
B.F-核内含有9个质子,核外含有10个质子;
C.该有机物为间羟基苯甲酸,不是邻羟基苯甲酸;
D.元素符号的左上角表示质量数,左下角表示质子数,质量数=质子数+中子数;
解答 解:A.过氧化氢是共价化合物,分子中不存在阴阳离子,过氧化氢正确的电子式为: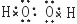 ,故A错误;
,故A错误;
B.F-核内含有9个质子,核外含有10个质子,结构示意图: ,故B正确;
,故B正确;
C.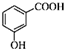 为间羟基苯甲酸,邻羟基苯甲酸在苯环邻位上有2个取代基:羟基和羧基,正确的结构简式为:
为间羟基苯甲酸,邻羟基苯甲酸在苯环邻位上有2个取代基:羟基和羧基,正确的结构简式为: ,故C错误;
,故C错误;
D.中子数为28的钙原子,其质量数为48,该钙原子正确的表示方法为:2048Ca,故D错误;
故选B.
点评 本题考查了常见化学用语的判断,注意掌握离子结构示意图、电子式、元素符号、结构简式等化学用语的概念及书写原则,试题侧重基础知识的考查,有利于培养学生灵活应用所学知识的能力,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列说法正确的是( )
| A. | 同时改变两个变量来研究化学平衡的移动,能更快得出有关规律 | |
| B. | 催化剂通过改变反应历程,降低反应的活化能来加快反应速率 | |
| C. | 可逆反应的平衡向正向移动,该反应的平衡常数一定增大 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
13.甲、乙两个恒容密闭容器中均发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0,有关数据如表所示.下列说法正确的是( )
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡时吸收的热量 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 | Q1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | Q2 |
| A. | T1<T2 | |
| B. | Q1>Q2 | |
| C. | 甲容器中,混合气体的密度始终保持不变 | |
| D. | 乙容器中,反应进行到1.5min时,n(H2O)=1.4mol |
3.利用自然资源制备相关化学物质,下列化工生产不可行的是( )
| A. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| B. | 石英砂$→_{高温}^{焦炭}$粗硅$\stackrel{Cl_{2}}{→}$粗SiCl4$→_{(2)H_{2}/高温}^{(1)分馏提纯}$高纯硅 | |
| C. | 提取食盐后的母液$\stackrel{Cl_{2}}{→}$含Br2的液体$\stackrel{热空气}{→}$$\stackrel{冷凝}{→}$粗Br2$→_{蒸馏}^{NaBr(s)}$Br2 | |
| D. | 铝土矿$→_{(2)过滤}^{(1)NaOH(aq)}$NaAlO2(aq)$→_{(2)过滤}^{(1)CO_{2}}$Al(OH)3$\stackrel{煅烧}{→}$Al2O3$→_{电解}^{煅烧}$Al |
7.下列离子方程式正确的是( )
| A. | NaOH溶液中通入少量CO2:CO2+OH-═HCO3- | |
| B. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-NH3↑+H2O | |
| C. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
8.下列各项化学用语表达正确的是( )
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: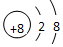 |
