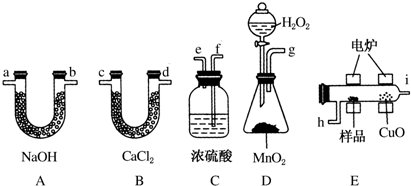
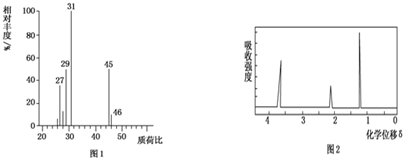
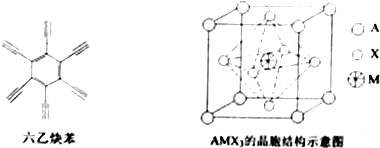
题目内容
7.下表是不同温度下水的离子积数据:| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
(1)若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14,
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42-)=2:1; c(Na+):c(OH-)=1000:1.
(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=5.
(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=3.3.
(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=10:1;
②若所得混合溶液pH=2,则a:b=9:2.(以上均忽略溶液混合前后体积的变化)
分析 (1)根据水的电离过程为吸热反应判断;
(2)根据硫酸钠的化学式组成判断c(Na+):c(SO42- );根据常温下氢离子浓度计算c(Na+):c(OH-);
(3)根据盐酸溶液稀释后氢离子浓度计算出溶液的pH;
(4)根据混合后溶液中氢离子浓度计算出溶液的pH;
(5)①若所得混合液为中性,酸碱恰好完全反应;
②若所得混合液的pH=2,酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$计算.
解答 解:(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大,故答案为:>;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42- )=2:1;硫酸钠溶液中c(Na+):c(OH-)=2×5×10-4 mol•L-1:1×10-7 mol•L-1=1000:1,
故答案为:2:1;1000:1;
(3)10mLpH=4的盐酸,氢离子浓度为1×10-4 mol•L-1,稀释10倍到100mL时,氢离子浓度为1×10-5 mol•L-1,溶液pH=5,
故答案为:5;
(4)常温下,pH=5的盐酸溶液中氢离子浓度为:1×10-5mol•L-1,pH=3的盐酸溶液中氢离子浓度为1×10-3mol•L-1,等体积混合后溶液中氢离子浓度为:$\frac{1×1{0}^{-5}V+1×1{0}^{-3}V}{2V}$≈5×10-4 mol•L-1,
混合溶液的pH为:pH=-lg5×10-4=4-lg5=3.3,
故答案为:3.3;
(5)①若所得混合液为中性,酸碱恰好完全反应,则有0.01mol/L×aL=0.1mol/L×bL,a:b=0.1:0.01=10:1,故答案为:10:1;
②若所得混合液的pH=2,酸过量,c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$=$\frac{0.1b-0.01a}{a+b}$=0.01,解之得:a:b=9:2,故答案为:9:2.
点评 本题考查酸碱混合pH的计算,明确浓度与pH的换算、酸碱混合溶液为中性、碱性时离子浓度的关系等是解答本题的关键,题目难度中等.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )
25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )| A. | c点时,c(Na+)=c(CH3COO-) | |
| B. | b点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | d点时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 从a点到c点间可能有:c(CH3COO-)>c(H+)=c(Na+)>c(OH-) |
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤 | |
| B. | KNO3固体中混有少量NaCl:加H2O配制热的饱和溶液,再冷却结晶、过滤 | |
| C. | 乙醇中的少量水:加入适量新制的生石灰,加热蒸馏 | |
| D. | 二氧化碳中混有少量一氧化碳:点燃除去 |
| A. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | B. | 2Fe+2H2O+O2═2Fe(OH)2 | ||
| C. | 2H2O+O2+4e-→4OH- | D. | Fe→Fe3++3e- |
| A. |  如图研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. |  如图研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. |  图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. |  图中t0时增大压强,使平衡向负反应方向进行 |
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.