题目内容
16.下列说法正确的是( )| A. | 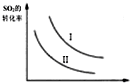 如图研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 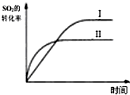 如图研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. |  图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 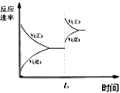 图中t0时增大压强,使平衡向负反应方向进行 |
分析 根据影响化学反应速率和化学平衡的因素进行判断得出正确结论.升高温度,化学反应速率加快,平衡向着吸热的方向移动;增大压强,化学反应速率加快,平衡向着气体体积减小的方向移动;使用催化剂,加快化学反应速率,对平衡不产生影响.
解答 解:A.正反应方向气体的物质的量减小,压强增大,平衡想正反应方向移动,二氧化硫的转化率增大,故A错误;
B.正反应为放热反应,升温反应速率加快,平衡向逆反应方向移动,二氧化硫的转化率减小,故B正确;
C.使用催化剂,加快化学反应速率,对平衡不产生影响,故C错误;
D.t0时,V正′>V逆′,平衡向正反应方向移动,故D错误;
故选B.
点评 本题考查化学反应速率、化学平衡与图象,题目难度中等.要注意催化剂对化学平衡无影响.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案
相关题目
7.下表是不同温度下水的离子积数据:
试回答以下问题:
(1)若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14,
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42-)=2:1; c(Na+):c(OH-)=1000:1.
(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=5.
(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=3.3.
(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=10:1;
②若所得混合溶液pH=2,则a:b=9:2.(以上均忽略溶液混合前后体积的变化)
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
(1)若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14,
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42-)=2:1; c(Na+):c(OH-)=1000:1.
(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=5.
(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=3.3.
(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=10:1;
②若所得混合溶液pH=2,则a:b=9:2.(以上均忽略溶液混合前后体积的变化)
1.如图所示,将两烧杯中电极用导线相连.当闭合开关S后,以下表述正确的是( )


| A. | 电流表指针不发生偏转 | |
| B. | Al、Pt两极有H2产生 | |
| C. | Mg、C两极生成的气体可以恰好完全反应 | |
| D. | 甲池pH减小,乙池pH不变 |
 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.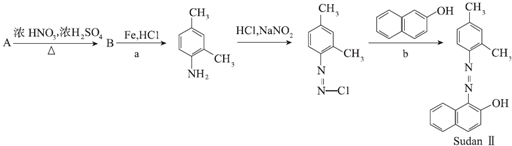
 .
.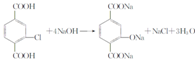 .②E→Fn
.②E→Fn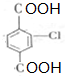 +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$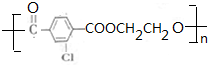 +2nH2O.
+2nH2O. 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.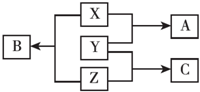 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题: ;
; 2NH3;
2NH3; 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
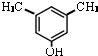 或
或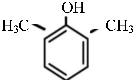 .
.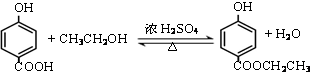 .
.