��Ŀ����
17��ijʵ���о�С����������ᾧ��ֽ�IJ��ﲢ�ⶨ�䴿�ȣ����ʲ�������Ӧ�����������ϣ����ᾧ�壨 H2C204•2H20��l00�濪ʼʧˮ��101.5C�ۻ���150�����ҷֽ����H2O��CO��C02�������ǿɹ�ѡ���ʵ��������ͼ��ijЩ����װ������ȥ����ʵ������ҩƷ���ޣ�
��l�������˼��ȷֽ���ᾧ���װ����C����ѡװ��A���ܻ���ɵĺ���ǹ���ҩƷ�ۻ���������Թܿڣ���ѡװ��B���ܻ���ɵĺ��������ˮ�ᵹ�����Թܵף�����Թ����ѣ�
��2���������������Ⱥ������C�����ţ���
A��CO2��H2O��CO B��CO��H2O��CO2 C��H2O��CO2��CO D��H2O��CO��CO2
��3��ʵ������װ�á�G����ʯ�ң�-F-D��CuO���壩-F������CO����F��ʢװ���Լ��dz����ʯ��ˮ��֤������CO��������ǰһ��F��û�л��ǣ���һ��F���г�����D�й��巴Ӧ��Ӻ�ɫ��ɺ�ɫ��
��4���ѷֽ�װ����װ��NaOH��Һ��Eװ��ֱ����ϣ�������ȫ�ֽ�����������������ⶨag���ᾧ��Ĵ��ȣ���ʵ��õ���������ΪV mL���ѻ���ɱ�״����������ᴿ�ȵı���ʽΪ$\frac{{\frac{{126��V��{{10}^{-3}}}}{22.4}}}{a}$��
��5�������ʵ�鷽�����������������ƽ�ⳣ��Ka2��ֵ������ʱ����pH�Ʋ���0.100mol/L��������Һ��pH����c��OH-��=$\frac{Kw}{c��{H}^{+}��}$������C2O42-+H2O?HC2O4-+OH������$\frac{K_W}{{{K_{a2}}}}=\frac{{{c^2}��O{H^-}��}}{{0.1-c��O{H^-}��}}$�������ݷ����в�õ���������д������Ka2�ı���ʽ${K_{a2}}=\frac{{0.1-c��O{H^-}��}}{{{c^2}��O{H^-}��}}��{K_W}$��
���� ��1�����ᾧ����۵�ͣ����������ۻ�����Cװ�ü��ȷֽ���ᾧ�壬���ڵĹ��岻�����£������ڼ��Ȳ��ᣬ��ѡ��װ��A���Ȼ�ʹ�����������ܻ��������Թܿڴ�����ѡ��װ��B�ֽ����ɵ�ˮ�ᵹ���Թܵײ�ը���Թܣ�
��2��150�����ҷֽ����H2O��CO��C02����������ļ���˳��Ӧ��ѭ���������Ҳ�����ţ�Ӧ�ȼ���ˮ���ټ��������̼��������һ����̼��
��3��ʵ������װ�á�G����ʯ�ң�-F-D��CuO���壩-F������CO��ͨ��װ��G����ˮ�Ͷ�����̼��ͨ��װ��F���������̼�Ƿ������ͨ��װ��D�����Ƿ���һ����̼��������ͭΪͭ�����ͨ��װ��F�����Ƿ����ɶ�����̼���壻
��4�����ᾧ�壨 H2C204•2H20��l00�濪ʼʧˮ��101.5C�ۻ���150�����ҷֽ����H2O��CO��C02����Ӧ�Ļ�ѧ����ʽΪ��H2C204•2H20$\frac{\underline{\;\;��\;\;}}{\;}$3H2O+CO+C02��ʵ��õ���������ΪV mL���ѻ���ɱ�״������Ϊһ����̼�����ʵ����Ͳ��ᾧ�����ʵ�����ͬ���ݴ˼��㣻
��5������ʱ����pH�Ʋ���0.100 mol/L ��������Һ��pH������ˮ��ƽ��C2O42-+H2O?HC2O4-+OH-������ƽ�ⳣ��Kh=$\frac{c��O{H}^{-}��c��H{C}_{2}{{O}_{4}}^{-}��}{c��{C}_{2}{{O}_{4}}^{2-}��}$=$\frac{Kw}{K{a}_{2}}$��
��� �⣺��1�������˼��ȷֽ���ᾧ���װ����C����ѡװ��A���ܻ���ɵĺ���ǹ���ҩƷ�ۻ���������Թܿڣ���ѡװ��B���ܻ���ɵĺ��������ˮ�ᵹ�����Թܵף�����Թ����ѣ�
�ʴ�Ϊ������ҩƷ�ۻ���������Թܿڣ�����ˮ�ᵹ�����Թܵף�����Թ����ѣ�
��2��150�����ҷֽ����H2O��CO��C02����������ļ���˳��Ӧ��ѭ���������Ҳ�����ţ�Ӧ�ȼ���ˮ���ټ��������̼��������һ����̼��
�ʴ�Ϊ��C��
��3��ʵ������װ�á�G����ʯ�ң�-F-D��CuO���壩-F������CO��ͨ��װ��G����ˮ�Ͷ�����̼��ͨ��װ��F���������̼�Ƿ������ͨ��װ��D�����Ƿ���һ����̼��������ͭΪͭ�����ͨ��װ��F�����Ƿ����ɶ�����̼���壬
�ʴ�Ϊ�������ʯ��ˮ��ǰһ��F��û�л��ǣ���һ��F���г�����D�й��巴Ӧ��Ӻ�ɫ��ɺ�ɫ��
��4����Ӧ�Ļ�ѧ����ʽΪ��H2C204•2H20$\frac{\underline{\;\;��\;\;}}{\;}$3H2O+CO+C02��ʵ��õ���������ΪV mL���ѻ���ɱ�״������Ϊһ����̼�����ʵ����Ͳ��ᾧ�����ʵ�����ͬ��n��H2C204•2H20��=n��CO��=$\frac{V��1{0}^{-3}}{22.4}$mol/L��
���ᴿ�ȵı���ʽ=$\frac{\frac{V��1{0}^{-3}}{22.4}mol��126g/mol}{ag}$=$\frac{{\frac{{126��V��{{10}^{-3}}}}{22.4}}}{a}$��
�ʴ�Ϊ��$\frac{{\frac{{126��V��{{10}^{-3}}}}{22.4}}}{a}$��
��5������ʱ����pH�Ʋ���0.100 mol/L ��������Һ��pH����c��OH-��=$\frac{Kw}{c��{H}^{+}��}$������ C2O42-+H2O?HC2O4-+OH-��Kh=$\frac{c��O{H}^{-}��c��H{C}_{2}{{O}_{4}}^{-}��}{c��{C}_{2}{{O}_{4}}^{2-}��}$=$\frac{c��O{H}^{-}��c��H{C}_{2}{{O}_{4}}^{-}��}{c��{C}_{2}{{O}_{4}}^{2-}��}$��$\frac{c��{H}^{+}��}{c��{H}^{+}��}$=$\frac{Kw}{K{a}_{2}}$����$\frac{K_W}{{{K_{a2}}}}=\frac{{{c^2}��O{H^-}��}}{{0.1-c��O{H^-}��}}$���õ�${K_{a2}}=\frac{{0.1-c��O{H^-}��}}{{{c^2}��O{H^-}��}}��{K_W}$��
�ʴ�Ϊ��${K_{a2}}=\frac{{0.1-c��O{H^-}��}}{{{c^2}��O{H^-}��}}��{K_W}$��
���� ���⿼���������ڵ�̽��ʵ����̷����жϣ���Ҫ�����ʼ��顢���ʺ����IJⶨ��������Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

| �¶ȣ��棩 | 25 | t1 | t2 |
| ˮ�����ӻ����� | 1��10-14 | �� | 1��10-13 |
��1����25��t1��t2����������������������=����1��10-14��
��2��25���£�ijNa2SO4��Һ��c��SO42-��=5��10-4 mol•L-1��ȡ����Һ1mL����ˮϡ����10mL����ϡ�ͺ���Һ��c��Na+����c��SO42-��=2��1�� c��Na+����c��OH-��=1000��1��
��3��10mLpH=4�����ᣬϡ��10����100mLʱ��pH=5��
��4�������£�pH=5��pH=3��������Һ�������Ϻ���Һ��pH=3.3��
��5����t2���¶���pH=11��NaOH��ҺaL��pH=1��H2SO4��ҺbL��ϣ�
�������û����ҺΪ���ԣ���a��b=10��1��
�������û����ҺpH=2����a��b=9��2�������Ͼ�������Һ���ǰ������ı仯��
| A�� | NO | B�� | NO2 | C�� | NH3 | D�� | SO2 |
| A�� | ��������ԭ��Ӧ�У��ǽ�������һ���������� | |
| B�� | ijԪ�شӻ���̬��Ϊ����̬ʱ����Ԫ��һ������ԭ | |
| C�� | ���������ӱ���ԭ��һ���õ��������� | |
| D�� | ������ԭ��Ӧ������Ԫ�صĻ��ϼ۶������仯 |
 ��
�� 2NH3��
2NH3�� ���������[��NH4��2Fe��SO4��2•6H2O]�������������ױ������������Ƿ�����ѧ����Ҫ���Լ��������ڴ������������������������ 500��ʱ��������������ȫ�ֽ⣮�ش��������⣺
���������[��NH4��2Fe��SO4��2•6H2O]�������������ױ������������Ƿ�����ѧ����Ҫ���Լ��������ڴ������������������������ 500��ʱ��������������ȫ�ֽ⣮�ش��������⣺
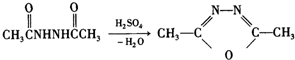
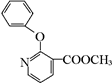 +H2N-NH2��
+H2N-NH2�� ��
�� ��
��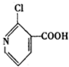 �ж���ͬ���칹�壬���з�������������ͬ���칹�干��4�֣�
�ж���ͬ���칹�壬���з�������������ͬ���칹�干��4�֣�
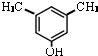 ��
�� ��
��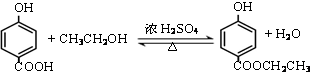 ��
��