题目内容
2.电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.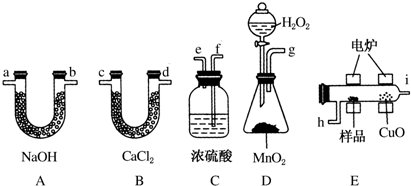
(1)产生的O2按从左到右的流向,所选各装置的正确连接顺序是
D→C→E→B→A.
(2)燃烧管中CuO的作用是使样品完全被氧化生成CO2和H2O,如果去掉CuO,则A管的质量会减少(填增大、减小或不变)
(3)请改进这套装置的一个不足之处在装置尾部连接一个装有碱石灰的干燥管
(4)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为C2H6O.
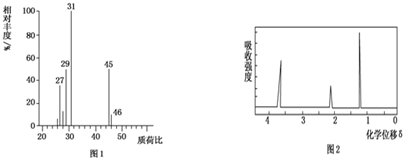
(5)用质谱仪测定其相对分子质量,得如图1所示的质谱图,则该有机物的相对分子质量为46.
(6)该物质的核磁共振氢谱如图2所示,则其结构简式为CH3CH2OH.
分析 (1)根据实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳、B用来吸收水、C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(2)由(1)得一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,如果去掉CuO,生成二氧化碳少;
(3)空气中二氧化碳也会进入装置A,使测定的二氧化碳质量增大;
(4)根据元素守恒法确定有机物的实验式,A管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:1.76g×$\frac{12}{44}$×100%=0.48g,B管质量增加1.08g说明生成了1.08g水,可得氢元素的质量:1.08g×$\frac{2}{18}$×100%=0.12g,从而可推出含氧元素的质量为:0.92g-0.48g-0.12g=0.32g;
(5)根据质谱图可知有机物的相对分子质量;
(6)核磁共振氢谱中峰值数等于有机物中氢原子的种类数确定有机物的种类.
解答 解:(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,所选择装置连接顺序是DCEBA,
故答案为:D;C;E;B;A;
(2)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,如果去掉CuO,则A管的质量会减少,
故答案为:使有机物更充分氧化为CO2、H2O;减少;
(3)空气中二氧化碳也会进入装置A,使测定的二氧化碳质量增大产生误差,所以需要在装置尾部连接一个装有碱石灰的干燥管,防止空气中的二氧化碳、水蒸气进入装置A产生测量误差,
故答案为:在装置尾部连接一个装有碱石灰的干燥管;
(4)A管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:1.76g×$\frac{12}{44}$×100%=0.48g,
B管质量增加1.08g说明生成了1.08g水,可得氢元素的质量:1.08g×$\frac{2}{18}$×100%=0.12g,从而可推出含氧元素的质量为:0.92g-0.48g-0.12g=0.32g,
设实验式为CXHYOZ,则X:Y:Z=$\frac{0.48}{12}$:$\frac{0.12}{1}$:$\frac{0.32}{16}$=2:6:1,即实验式为:C2H6O,
故答案为:C2H6O;
(5)质谱图可知有机物的相对分子质量为46,故答案为:46;
(6)核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,所以其结构简式为:CH3CH2OH,故答案为:CH3CH2OH.
点评 本题考查有机物的分子式、结构简式的确定,题目难度中等,关键在于清楚实验的原理,掌握实验方法,掌握基础是解题关键.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 蒸干AlCl3溶液可得AlCl3固体 | |
| B. | 向FeCl3溶液中加少量盐酸,抑制Fe3+水解 | |
| C. | 用纯碱溶液清洗油污时,加热可以增强其去污力 | |
| D. | 除去MgCI2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3 |
| A. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- | |
| B. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | pH=7的溶液中:Al3+、K+、Cl-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
| A. | 该溶液的溶质不可能是NaHSO4 | |
| B. | 向该溶液中加入铝粉,一定能产生大量H2 | |
| C. | 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+ | |
| D. | 向该溶液中加入NaHCO3固体,一定有化学反应发生 |
| A. | CH3COOH | B. | HOOC-COOH | C. | HO(CH2)2CHO | D. | HOC6H4COOH |
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
(1)若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14,
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42-)=2:1; c(Na+):c(OH-)=1000:1.
(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=5.
(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=3.3.
(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=10:1;
②若所得混合溶液pH=2,则a:b=9:2.(以上均忽略溶液混合前后体积的变化)
| A. | a=b | B. | a<b | C. | a>b | D. | 不能确定 |
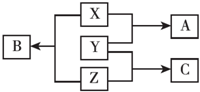 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题: