题目内容
19.六乙炔苯在铜片表面发生催化反应,可制得石墨炔,将其掺杂在钙钛矿型太阳能电池材料中,能有效地提高电子传输性能.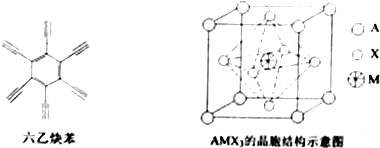
(1)铜原子基态核外价电子排布式为3d104s1 .
(2)六乙炔苯中碳原子的轨道杂化类型是sp、sp2,1mol六乙炔苯中含有δ键的数目为24mol或24×6.02×1023个;
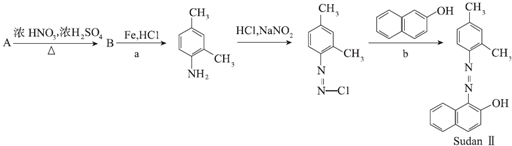
(3)该电池材料之一是AMX3,A为CH3NH3+(甲胺正离子),M为Pb2+,X为I-,其晶胞结构如图所示.
①与CH3NH3+互为等电子体的一种分子为CH3CH3或C2H6 (填结构简式).
②每个A离子周围最近且等距离的M离子数目为8.
③制备AMX3用到的PbI2难溶于水,可溶于HI溶液,生成H2[PbI4].请写出PbI2和HI溶液反应的离子方程式PbI2+2I-=[PbI4]2-(已知H2[PbI4]在溶液里完全电离出两种离子).
分析 (1)Cu属于29号元素,根据构造原理书写基态核外价电子排布式;
(2)根据价层电子对互斥理论确定原子杂化方式;每摩尔单键、双键或三键中只有一摩尔δ键;
(3)①根据等电子体中原子数相同、价电子数相同分析,CH3NH3+的电子数为18,原子数为8;
②根据晶胞结构判断,与A离子距离最近的M离子处于晶胞的体心上,A离子位于晶胞顶点,M离子位于体心;
③PbI2难溶于水,可溶于HI溶液,生成H2[PbI4],根据强酸制弱酸原理书写.
解答 解:(1)Cu属于29号元素,根据构造原理知Cu基态核外电子排布式1s22s22p63s23p63d104s1 ,故价电子排布式为3d104s1,
故答案为:3d104s1;
(2)碳碳三键中C原子价层电子对个数是2且不含孤电子对,所以杂化方式为sp;苯环中的碳形成3个δ键,无孤电子对,采取sp2杂化,1mol六乙炔苯中共含有包括碳碳键和碳氢键在内的化合键24mol,而每摩尔单键、双键或三键中只有一摩尔δ键,所以1mol六乙炔苯中含有δ键的数目为24mol或24×6.02×1023个,
故答案为:sp、sp2;24mol或24×6.02×1023个;
(3)①CH3NH3+的电子数为18,原子数为8,其等电子体的一种分子为CH3CH3或C2H6 ,
故答案为:CH3CH3或C2H6;
②根据晶胞结构可知,与A离子距离最近的M离子处于晶胞的体心上,A离子位于晶胞顶点,M离子位于体心,所以每个A离子周围最近且等距离的M离子数目为8,
故答案为:8;
③PbI2难溶于水,可溶于HI溶液,生成H2[PbI4],反应的离子方程式为PbI2+2I-=[PbI4]2-,
故答案为:PbI2+2I-=[PbI4]2-.
点评 本题考查了价电子的排布式、晶胞的计算、原子杂化方式判断等知识点,题目难度中等,注意识记中学常见的晶胞结构.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 该溶液的溶质不可能是NaHSO4 | |
| B. | 向该溶液中加入铝粉,一定能产生大量H2 | |
| C. | 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+ | |
| D. | 向该溶液中加入NaHCO3固体,一定有化学反应发生 |
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
(1)若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14,
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42-)=2:1; c(Na+):c(OH-)=1000:1.
(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=5.
(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=3.3.
(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=10:1;
②若所得混合溶液pH=2,则a:b=9:2.(以上均忽略溶液混合前后体积的变化)
| A. | a=b | B. | a<b | C. | a>b | D. | 不能确定 |
| A. | NO | B. | NO2 | C. | NH3 | D. | SO2 |
 .
. .②E→Fn
.②E→Fn +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$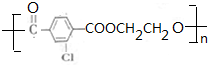 +2nH2O.
+2nH2O. 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.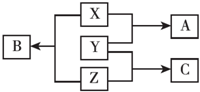 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题: ;
; 2NH3;
2NH3;