题目内容
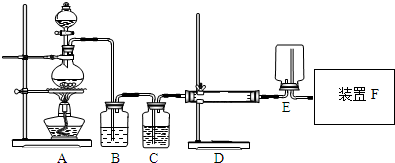
11.I.如图1为实验室制乙烯的发生装置以及乙烯性质检验装置,其中利用乙醇分子内脱水的原理来制备乙烯,反应方程式如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.请回答下列问题:实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

(1)图1中装置A的仪器①、②名称分别为温度计、圆底烧瓶_;
(2)实验过程中向B装置(溴水)中通入制备所得到的气体,溶液的颜色很快褪去,分析使B中溶液褪色的物质:
a.甲认为是C2H4.根据甲的判断,写出反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br;该反应属于加成反应(填反应类型);
b.乙根据现象Ⅲ认为,在制取乙烯的实验中因温度过高使乙醇和浓硫酸反应生成少量的SO2,不能排除SO2的影响.根据乙的观点,写出在B中与SO2 反应使溶液褪色的反应方程式SO2+Br2+2H2O=2H2SO4+2HBr;
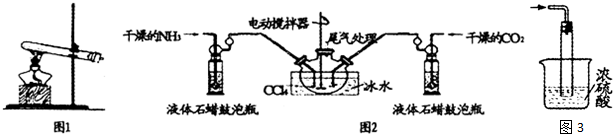
II.有人设计如图2装置进行实验以确认上述混合气体中有乙烯及二氧化硫.试回答下列问题:
(3)图中①②③④装置内,添加选择合适的试剂进行实验,以确认混合气体内的成分(按照仪器顺序从左到右填序号,可重复选择试剂):①A;②B;③A;④D;
A.品红溶液 B.氢氧化钠溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(4)根据装置内所选择的试剂,能说明二氧化硫气体存在的现象是装置①品红溶液褪色;使用装置②的目的是除去混合气体中的SO2,避免干扰实验结果;
(5)确定含有乙烯的现象是装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.
分析 (1)根据仪器①②的构造写出仪器①②的名称;
(2)a.乙烯分子中含有碳碳双键,能够与溴的四氯化碳发生加成反应生成1,2-二溴乙烷;
b.SO2能和溴水发生氧化还原反应;
(3)二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯;
(4)二氧化硫使品红溶液褪色,也能是使高锰酸钾酸性溶液褪色;
(5)通过品红溶液不褪色确认SO2已除干净,再用高锰酸钾酸性溶液褪色检验乙烯.
解答 解:(1)图1中仪器①用于测量反应温度,名称为温度计;仪器②由于盛放乙醇和浓硫酸的混合液,名称为圆底烧瓶,
故答案为:温度计;圆底烧瓶;
(2)a.向溴的四氯化碳溶液中通入乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,所以溶液的颜色很快褪去,反应的方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应;
b.SO2 使溶液褪色的反应方程式,SO2+Br2+2H2O=2H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=2H2SO4+2HBr;
(3)因装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置②试管装有NaOH溶液除去SO2,装置③试管通过品红溶液不褪色确认SO2已除干净,装置④通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:①A;②B;③A;④D;
(4)装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置②试管装有NaOH溶液除去混合气体中的SO2,避免干扰实验结果,
故答案为:装置①品红溶液褪色;除去混合气体中的SO2,避免干扰实验结果;
(5)装置③试管通过品红溶液不褪色,装置④通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.
点评 本题主要考查了乙烯的实验室制法,实验室制乙烯产物的检验,当有多种产物需检验时,应考虑先后顺序,在除去杂质气体时不能引入新杂质,题目难度中等,注意掌握常见仪器的干燥及使用方法,明确乙烯的实验室制法、性质及反应原理.

| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |