题目内容
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )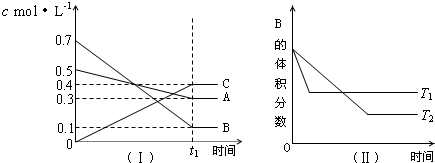
| A. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| D. | 由图(Ⅱ)可知,T1>T2,且该正反应为吸热反应 |
分析 该反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.在(t1+10)min时,增大压强,平衡向气体体积减小的方向移动;
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,为保持恒压,体积增大压强减小,平衡向气体体积增大的方向移动;
C.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
D.根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积分数增大,平衡向吸热反应方向移动;
解答 解:反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.该反应的正反应是气体体积减小的反应,在(t1+10)min时,保持其它条件和物质状态不变,增加压强,化学平衡向正反应方向移动,故A错误;
B.(t1+10)min时,保持压强不变,通入稀有气体,容器体积变大,反应物所占分压减小,平衡向体积增大的方向移动,由上面分析可知,该平衡体系的化学反应方程式为A(g)+3B(g)?2C(g),平衡逆向移动,故B正确;
C.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故C错误;
D.根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积分数增大,说明升温平衡逆向进行,正反应为放热反应,故D错误;
故选B.
点评 本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

| A. | 常温常压下,28 g N2所含电子数为10NA | |
| B. | 46 g钠充分燃烧时转移电子数为2NA | |
| C. | 0.1 mol•L-1NH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
| A. | c(NH4+)>c(SO42-),c(OH-)>c(H+) | B. | c(NH4+)=c(SO42-),c(OH-)=c(H+) | ||
| C. | c(NH4+)>c(SO42-),c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+),c(H+)>c(OH-) |
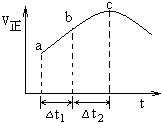 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 该反应为放热反应 | |
| B. | 反应物浓度:c>b>a | |
| C. | a、b均未建立平衡,c点恰好达到平衡 | |
| D. | 若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率小于绝热恒容容器中的转化率 |
| A. | 氯化钠的电子式 | B. | 氢气的结构式H=H | ||
| C. | 磷原子的结构示意图 | D. | 乙酸的分子式C2H4O2 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 自然界存在或不存在的有机物都可以利用人工合成出来 | |
| C. | 有机化合物的定量分析法最早由瑞典化学家贝采里乌斯提出的 | |
| D. | 著名的有机合成化学家李比希曾说:“有机合成的威力体现为在老的自然界旁边再建立起一个新的自然界.” |
 ,氯化钙
,氯化钙 ,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.
,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.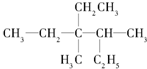 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷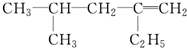
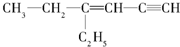 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8