题目内容
20.NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 常温常压下,28 g N2所含电子数为10NA | |
| B. | 46 g钠充分燃烧时转移电子数为2NA | |
| C. | 0.1 mol•L-1NH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
分析 A.氮气分子中含有14个电子,根据n=$\frac{m}{M}$计算出氮气的物质的量,再计算出含有的电子数;
B.钠为+1价金属,根据n=$\frac{m}{M}$计算出钠的物质的量,从而可计算出转移电子数;
C.没有告诉氯化铵溶液的体积,无法计算溶液中氯离子的物质的量;
D.二氧化氮与四氧化二氮之间存在转化平衡,部分二氧化氮转化成了四氧化二氮.
解答 解:A.28g氮气的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol氮气分子中含有14mol电子,所含电子数为14NA,故A错误;
B.46g钠的物质的量为:$\frac{46g}{23g/mol}$=2mol,2molNa完全燃烧生成2mol钠离子,转移了2mol电子,转移电子数为2NA,故B正确;
C.缺少0.1 mol•L-1NH4Cl溶液的体积,无法计算氯离子的物质的量,故C错误;
D.2 mol NO与1 mol O2充分反应生成2mol二氧化氮,由于部分二氧化氮转化成了四氧化二氮,则产物的分子数小于2NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;D为易错点,注意二氧化氮与四氧化二氮之间存在转化平衡.

练习册系列答案
相关题目
10.下列有关NaClO和NaCl混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、CH3CHO可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
11.下列条件中,两种气体所含原子数一定相等的是( )
| A. | 同质量、不同密度的N2和CO | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H6和NO | D. | 同压强、同体积的N2O和CO2 |
8.下列实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  蒸馏 | ||
| C. |  过滤 | D. |  观察K+的焰色 |
15.下列说法不正确的是( )
| A. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| C. | 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 | |
| D. | 石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体 |
5.在298K、1.01×105Pa下,将22g CO2通入750mL 1mol•L-1 NaOH的溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2mol•L-1 NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
12.下列离子方程式书写正确的是( )
| A. | 向50mL 1mol•L-1明矾溶液中滴入少量0.1mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
9.下列电离方程式中,正确的是( )
| A. | NaHCO3=Na++HCO3- | B. | H2SO4?2H++SO42- | ||
| C. | NaHSO3=Na++H++SO32- | D. | 熔融状态下:NaHSO4=Na++H++SO42- |
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
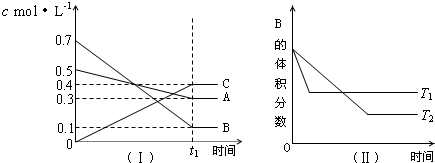

| A. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| D. | 由图(Ⅱ)可知,T1>T2,且该正反应为吸热反应 |