题目内容
1.用0.10mol/L H2SO4溶液滴定0.1mol/L的氨水,滴定的过程中不可能出现的结果是( )| A. | c(NH4+)>c(SO42-),c(OH-)>c(H+) | B. | c(NH4+)=c(SO42-),c(OH-)=c(H+) | ||
| C. | c(NH4+)>c(SO42-),c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+),c(H+)>c(OH-) |
分析 用0.10mol/L H2SO4溶液滴定0.1mol/L的氨水,当滴入少量硫酸时,溶液呈碱性,则c(OH-)>c(H+)、c(NH4+)>c(SO42-);当溶液为中性时,c(OH-)=c(H+)、2c(NH4+)=c(SO42-);当反应生成硫酸氢铵时,溶液呈酸性,则c(H+)>c(OH-)、c(SO42-)>c(NH4+);当溶液硫酸铵时,铵根离子部分水解,溶液为酸性,则c(H+)>c(OH-)、c(NH4+)>c(SO42-),据此进行解答.
解答 解:A.当滴入的硫酸较少时,溶液呈碱性,则可能满足:c(OH-)>c(H+)、c(NH4+)>c(SO42-),故A错误;
B.当滴入硫酸适量时,溶液呈中性,则c(OH-)=c(H+)、2c(NH4+)=c(SO42-),不可能出现c(NH4+)=c(SO42-)、c(OH-)=c(H+),故B正确;
C.当溶液硫酸铵时,铵根离子水解,溶液为酸性,则c(H+)>c(OH-),由于水解程度减小,则c(NH4+)>c(SO42-),该关系可能出现,故C错误;
D.当反应生成硫酸氢铵时,溶液呈酸性,则满足:c(H+)>c(OH-)、c(SO42-)>c(NH4+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.下列条件中,两种气体所含原子数一定相等的是( )
| A. | 同质量、不同密度的N2和CO | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H6和NO | D. | 同压强、同体积的N2O和CO2 |
12.下列离子方程式书写正确的是( )
| A. | 向50mL 1mol•L-1明矾溶液中滴入少量0.1mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
9.下列电离方程式中,正确的是( )
| A. | NaHCO3=Na++HCO3- | B. | H2SO4?2H++SO42- | ||
| C. | NaHSO3=Na++H++SO32- | D. | 熔融状态下:NaHSO4=Na++H++SO42- |
16.从硫粉和铁粉的混合物中提取硫,最合理的方法是( )
| A. | 用磁铁分离出混合物中的铁粉 | B. | 将混合物溶于二硫化碳后过滤 | ||
| C. | 将混合物溶解于稀盐酸后过滤 | D. | 将混合物加热升华 |
6.下列关于金属元素特征的叙述中,正确的是( )
①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中都显正价
③元素的金属性越强,相应的离子氧化性越弱
④失电子数越多,元素的金属性越强.
①金属元素的原子只有还原性,离子只有氧化性
②金属元素在化合物中都显正价
③元素的金属性越强,相应的离子氧化性越弱
④失电子数越多,元素的金属性越强.
| A. | .①②③ | B. | ②③ | C. | ① | D. | 全部 |
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
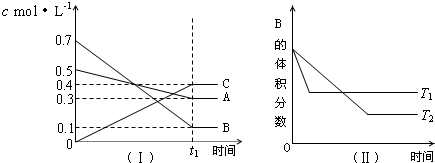

| A. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| D. | 由图(Ⅱ)可知,T1>T2,且该正反应为吸热反应 |
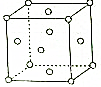 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题: 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g),发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g).
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g),发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g).