题目内容
20.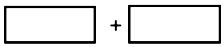 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.(1)已知KBrO3在反应中得到电子,则该反应的还原剂是AsH3.
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为Br2.
(3)根据上述反应可推知ac.(填序号)
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂化学式及其配平后的系数和还原剂化学式及其配平后的系数分别填入如图所示方框中,并用单线桥标出电子转移的方向和数目.
(5)请按下列要求完成相关书写:
a.皮肤上由于粘了KMnO4而形成的黑斑,如果用草酸(H2C2O4显酸性)溶液洗涤,黑斑可以迅速褪去,写出该反应的离子方程式2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
b.冶金工业产生的废水中含有有毒的CN-,工业上处理这种废水是在碱性条件下,用NaClO来处理.产物中只有一种是气体,写出反应的离子方程式5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O.
c.某洗气瓶中装有5.0ml1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移了5.0×10-5mol电子,写出该反应的化学方程式5Cl2+I2+6H2O=10HCl+2HIO3.
分析 由信息可知,该反应中氧化剂是KBrO3,还原剂是AsH3,溴元素化合价变化为由+5价降低,As元素化合价变化为-3→+5价,
(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此判断;
(4)根据化合价的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数;
(5)a.KMnO4具有氧化性H2C2O4具有还原性,两者能发生氧化还原反应,据此书写离子方程式;
b.次氯酸根离子具有氧化性,可以将氢氰根离子氧化,在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体氮气,原理方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
c.通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
解答 解:(1)KBrO3在反应中得到电子,所以KBrO3化合价降低是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂,
故答案为:AsH3;
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2,
故答案为:Br2;
(3)a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确,b错误;
c、AsH3是还原剂,X是还原产物,所以还原性AsH3>X,故c正确,故d错误.
故选:ac;
(4)KBrO3在反应中得到电子,AsH3具失去电子,转移的电子数为40e-,则标出电子转移的方向和数目为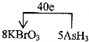 ,故答案为:
,故答案为: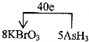 ;
;
(5)a.KMnO4具有氧化性H2C2O4具有还原性,两者能发生氧化还原反应,故离子方程式为2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
b.次氯酸根离子具有氧化性,可以将氢氰根离子氧化,在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体氮气,原理方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,故答案为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
c.装有5.0mL 1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,故I元素在氧化产物中的化合价为$\frac{5.0×1{0}^{-2}mol}{0.005L×1.0mol/L}$=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
故答案为:5Cl2+I2+6H2O=10HCl+2HIO3.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案| A. | 小于100 mL | B. | 等于100 mL | C. | 大于100 mL | D. | 等于100/ρ mL |
的说法正确的是( )
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子的核电荷数为3 | D. | 原子结构示意图为  |
| A. | 溶液中含有1molNa+ | |
| B. | 将142g Na2SO4溶于少量水后再稀释到 100mL | |
| C. | 1 mol Na2SO4溶于1 L蒸馏水中 | |
| D. | 1 L溶液中含有142 g Na2SO4 |
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用萃取的方法提取碘水中的碘 | |
| D. | 用结晶的方法分离氯化钠和硝酸钾的混合物 |
 ,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).
,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).