题目内容
20.向100g浓度为c mol•L-1,密度为ρ g•cm-3的食盐水中加入一定量的水,将其稀释至0.5c mol•L-1,则加入水的体积( )| A. | 小于100 mL | B. | 等于100 mL | C. | 大于100 mL | D. | 等于100/ρ mL |
分析 溶液在稀释前后溶质的质量不变,食盐水浓度越大,密度越大,质量分数ω越大,据此结合c=$\frac{1000ρω}{M}$列式计算即可,注意水的密度比氯化钠溶液的密度小.
解答 解:稀释前后溶质的质量不变,设加水的质量为x,稀释前的质量分数为w1,稀释后的质量分数为w2,
则:100g×ω1=(100g+x)×ω2,
c mol•L-1食盐水加入一定量的水稀释至0.5c mol•L-1,由c=$\frac{1000ρω}{M}$,可得:c1=$\frac{1000ρω{\;}_{1}}{M}$=c=2c2=$\frac{1000ρ{ω}_{2}}{M}$×2,食盐水浓度越大,密度越大,则ρ1>ρ2,
$\frac{{ω}_{1}}{{ω}_{2}}$=2×$\frac{{ρ}_{2}}{{ρ}_{1}}$<2,
所以:$\frac{100+x}{100}$=$\frac{{ω}_{1}}{{ω}_{2}}$<2,
解得:x<100g,
又水的密度约为1g/mL,则加水的体积小于100mL,
故选:A.
点评 本题考查物质的量浓度计算,难度中等,掌握物质的量浓度根据及表达式,学生容易忽略密度与浓度、质量分数的关系及水的密度与食盐水的密度大小,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
15.已知元素X,Y的核电荷数分别为a和b,它们的离子Xn+的Ym-的核外电子排布完全相同,则下列关系中正确的是( )
| A. | a+m=b-n | B. | a+b=m+n | C. | a-m=b+n | D. | a+m=b-n |
5.F2和Xe在一定条件下生成氧化性极强且极易与水反应的XeF2、XeF4和XeF6三种化合物.其中XeF4与H2O可以发生如下反应:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列判断正确的是( )
| A. | 上述反应中氧化剂和还原剂的物质的量之比为l:2 | |
| B. | XeF4按以上方式与水反应,每生成3molO2转移12mol电子 | |
| C. | XeF2加入水中,在水分子的作用下,将重新生成Xe和F2 | |
| D. | XeF2、XeF4和XeF6在空气中都能长期存放 |
12.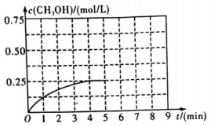 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
(1)该温度下此反应的平衡常数K为4.
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.

 .
. 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.