题目内容
9.按要求书写下列离子方程式:(1)向明矾溶液中滴加氢氧化钡溶液使硫酸根离子恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O
(2)向稀硝酸中加入过量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
(3)NH4HSO3与NaOH等物质的量反应:HSO3-+OH-=SO32-+H2O
(4)向NaOH溶液中通入过量SO2气体:OH-+SO2=HSO3-.
分析 (1)硫酸根离子恰好完全沉淀时,铝离子与氢氧根离子恰好反应生成偏铝酸根离子;
(2)向稀硝酸中加入过量铁粉反应生成硝酸亚铁和一氧化氮和水;
(3)NH4HSO3与NaOH等物质的量反应实质亚硫酸氢根离子与氢氧根离子反应生成亚硫酸根离子和和水;
(4)向NaOH溶液中通入过量SO2气体,反应生成亚硫酸氢钠.
解答 解:(1)向明矾溶液中加氢氧化钡溶液使硫酸根离子恰好完全沉淀,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O;
(2)向稀硝酸中加入过量铁粉反应生成硝酸亚铁和一氧化氮和水,离子方程式:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(3)NH4HSO3与NaOH等物质的量反应,离子方程式:HSO3-+OH-=SO32-+H2O;
故答案为:HSO3-+OH-=SO32-+H2O;
(4)向NaOH溶液中通入过量SO2气体,反应生成亚硫酸氢钠,离子方程式:OH-+SO2=HSO3-;
故答案为:OH-+SO2=HSO3-;
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,明确离子方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
1.下列检验方法错误的是( )
| A. | 加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42- | |
| B. | 某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO | |
| C. | 加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中肯定存在NH4+ | |
| D. | 加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I- |
18.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2.当n=4时,这类有机物开始有同分异构体.
(3)B的分子式为C6H6,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: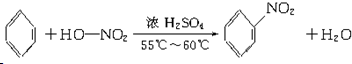 ;
;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
| A | B | C | D | E |
| ①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为: 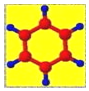 | ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为: 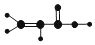 |
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2.当n=4时,这类有机物开始有同分异构体.
(3)B的分子式为C6H6,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 ;
;(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
19.下列有关实验叙述不正确的是( )
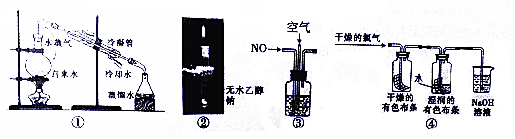

| A. | 图①用于除去自来水中的Fe3+、C1-等杂质离子 | |
| B. | 图②中直接点燃气体,证明钠与乙醇反应的气体产物是H2 | |
| C. | 图③在探究NO充分转化成HNO3的实验中,观察气泡速率控制通入气体体积比 | |
| D. | 图④用该实验可以证明Cl2体现漂白作用的原因 |
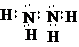 .
. 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.