题目内容
8.氯的原子序数为17,35Cl是氯的一种同位素,1mol的H35Cl分子所含中子数约为18NA,所含电子数约为18NA.分析 根据中子数=质量数-质子数计算出H35Cl含有中子数,然后可计算出1molH35Cl分子所含中子的物质的量及数目;H35Cl分子中含有18mol电子,据此计算出含有电子数.
解答 解:氯的原子序数为17,35Cl含有中子数为:35-17=18,H原子中子数为0,则1molH35Cl分子含有18mol中子,含有中子数为18NA;
H35Cl分子中含有电子数为:1+17=8mol,则1molH35Cl含有电子数为18NA,
故答案为:18NA;18NA.
点评 本题考查原子构成,题目难度不大,明确质量数与质子数、中子数之间的关系为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
16.下列反应离子方程式正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- |
13.在指定条件下,下列各组离子一定能大量共存的是( )
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | 滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
18.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2.当n=4时,这类有机物开始有同分异构体.
(3)B的分子式为C6H6,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: ;
;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
| A | B | C | D | E |
| ①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为: 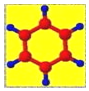 | ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为: 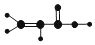 |
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2.当n=4时,这类有机物开始有同分异构体.
(3)B的分子式为C6H6,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 ;
;(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
 .
.
 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.