题目内容
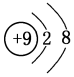
10.安全气囊是行车安全的重要设施.当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客.为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究.经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素.(1)氧离子的结构示意图是
 ,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).
,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是离子键、共价键.
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式.Fe2O3+6HCl=2FeCl3+3H2O.
分析 (1)氧离子核外有2个电子层,最外层电子数为8;可根据与氢气反应的剧烈程度以及氢化物的稳定性等比较非金属性强弱;三种主族元素为Na、N、O,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小;
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,应为硝酸铵,含有离子键和共价键;
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,为氧化铁,可与盐酸反应生成氯化铁和水.
解答 解:(1)氧离子核外有2个电子层,最外层电子数为8,示意图为 ;氧气与氢气化合更容易,生成的水比氨气更稳定,可知O的非金属性比N强,三种主族元素为Na、N、O,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径N3->O2->Na+,
;氧气与氢气化合更容易,生成的水比氨气更稳定,可知O的非金属性比N强,三种主族元素为Na、N、O,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径N3->O2->Na+,
故答案为: ;氧气与氢气化合更容易,生成的水比氨气更稳定;N3->O2->Na+;
;氧气与氢气化合更容易,生成的水比氨气更稳定;N3->O2->Na+;
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,应为硝酸铵,为离子化合物,含有离子键和共价键,故答案为:离子键、共价键;
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,为氧化铁,可与盐酸反应生成氯化铁和水,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,
故答案为:Fe2O3+6HCl=2FeCl3+3H2O.
点评 本题考查较为综合,涉及原子结构与性质关系、离子半径、盐类水解、化学键等,为高考常见题型,侧重考查学生的分析能力,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
1.下列检验方法错误的是( )
| A. | 加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42- | |
| B. | 某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO | |
| C. | 加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中肯定存在NH4+ | |
| D. | 加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I- |
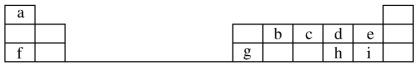
18.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2.当n=4时,这类有机物开始有同分异构体.
(3)B的分子式为C6H6,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: ;
;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
| A | B | C | D | E |
| ①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为: 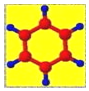 | ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为: 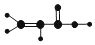 |
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2.当n=4时,这类有机物开始有同分异构体.
(3)B的分子式为C6H6,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 ;
;(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
19.下列有关实验叙述不正确的是( )
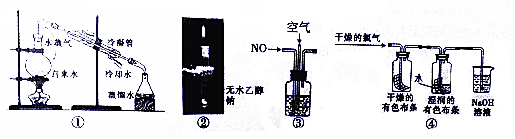

| A. | 图①用于除去自来水中的Fe3+、C1-等杂质离子 | |
| B. | 图②中直接点燃气体,证明钠与乙醇反应的气体产物是H2 | |
| C. | 图③在探究NO充分转化成HNO3的实验中,观察气泡速率控制通入气体体积比 | |
| D. | 图④用该实验可以证明Cl2体现漂白作用的原因 |
15.下列现象不是由平衡移动引起的是( )
| A. | 氯水光照颜色变浅 | |
| B. | 使用排饱和食盐水的方法收集氯气 | |
| C. | H2、I2、HI平衡混合气加压颜色变深 | |
| D. | 把有缺陷的胆矾晶体,投入饱和的硫酸铜溶液,一段时间后,晶体变为规则结构. |
 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.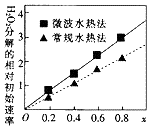 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.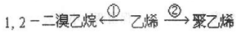
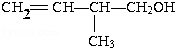
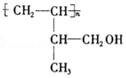 ;
; .
.
 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为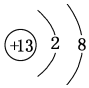 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.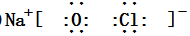 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.