题目内容
11.Ⅰ、请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式:HNO3+FeCl2→N2O+Fe(NO3)3+FeCl3+H2O(不需配平)Ⅱ、(1)配平下列离子反应方程式:
2Fe(OH)3+(5-n)ClO-+2nOH-→2FeO4n-+(5-n)Cl-+(n+3)H2O
(2)已知有10.7g Fe(OH)3参加反应,共转移了0.3NA个电子,则n=2,FeO4n-中铁元素的化合价为+6.
(3)根据所学的知识,推测FeO4n-能与下列BC(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
(4)一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是5:6.
分析 Ⅰ、元素处于最高价只有氧化性,元素居于低价有还原性,根据所给物质的化合价情况来分析;
Ⅱ、(1)元素的化合价变化分别是:Fe元素由Fe(OH)3中+3价变成-FeO4n中+(8-n)价,失去电子数为(5-n)个,Cl元素由ClO-中的+1价变成Cl-中的-1价,得电子数为2个;根据氧化还原反应中得失电子守恒,其最小公倍数为2(5-n),所以Fe(OH)3计量数是2,ClO-计量数是(5-n),并根据元素守恒进行配平;
(2)反应中Fe元素化合价升高,被氧化,Cl元素化合价降低,被还原,结合氧化还原反应中氧化剂、还原剂得失电子数目相等计算;
(3)FeO4n-中Fe的化合价为+6价,为高价态,具有强氧化性,能和强还原性的物质反应;
(4)32gCH30H转移6mol电子,即1mol还原剂参加反应转移6mol电子,根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少;
解答 解:Ⅰ、所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,得电子数是4mol,能将还原性的4molFeCl2氧化为Fe(NO3)3,4mol物质失电子数是4mol,根据氢原子守恒,水在生成物中,故发生的反应为:HNO3+FeCl2→N2O+Fe(NO3)3+FeCl3+H2O,
故答案为:HNO3;FeCl2;N2O;Fe(NO3)3;FeCl3;
Ⅱ、(1)元素的化合价变化分别是:Fe元素由Fe(OH)3中+3价变成-FeO4n中+(8-n)价,失去电子数为(5-n)个,Cl元素由ClO-中的+1价变成Cl-中的-1价,得电子数为2个;根据氧化还原反应中得失电子守恒,其最小公倍数为2(5-n),所以Fe(OH)3计量数是2,ClO-计量数是(5-n),并根据元素守恒进行配平,故方程式2Fe(OH)3+(5-n)ClO-+2nOH-→2FeO4n-+(5-n)Cl-+(n+3)H2O,
故答案为:2; (5-n); 2n;2;( 5-n );(n+3);
(2)n(Fe(OH)3)=$\frac{10.7g}{107g/mol}$=0.1mol,设Fe被氧化生成的FeO4n-中Fe元素化合价为x,则0.1mol×(x-3)=0.3mol,x=6,由化合价代数和为0可知,n=2,
故答案为:2;+6;
(3)FeO4n-中Fe的化合价为+6价,为高价态,具有强氧化性,能和强还原性的物质反应.SO2和H2S具有还原性,故答案为:BC;
(4)消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故答案为:5:6.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案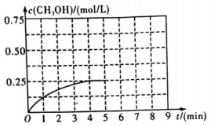 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- |
| A. | 加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42- | |
| B. | 某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO | |
| C. | 加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中肯定存在NH4+ | |
| D. | 加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I- |
 .
.
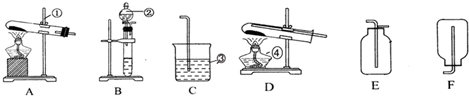
 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.