题目内容
6.相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡.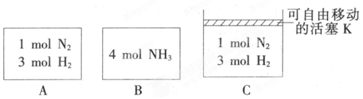
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1<c2(填“>”、“<”或“=”).
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A),α(B),则 α(A)+α(B)<1(填“>”、“<”或“=”).
③达到平衡时,若容器C的体积是起始时的$\frac{3}{4}$,则平衡时容器C中H2的体积分数为50%.
分析 ①A为恒容容器,C为恒压容器,随着反应的进行,容器体积减小,则C相当于对A加压,根据压强对平衡的影响分析;
②因体积相同,将乙中的量极限转化后为甲中的2倍,则压强大于甲中的压强,减小氨气的转化率;
③根据已知数据列三段式计算,根据恒压条件下物质的量之比等于体积比.
解答 解:①A为恒容容器,C为恒压容器,该反应气体体积减小,随着反应的进行,容器体积减小,则C相当于对A加压,增大压强,平衡正向移动,氨气的浓度增大,所以C容器内氨气浓度大;
故答案为:<;
②因体积相同,将乙中的量极限转化后为甲中的2倍,则压强大于甲中的压强,增大压强向生成氨气的方向移动,所以减小了氨气的转化率,所以α(A)+α(B)<1,
故答案为:<;
③对反应列三段式有:
N2 (g)+3H2(g)?2NH3(g)
n始:1 3 0
n转:x 3x 2x
n平:1-x 3-3x 2x
达到平衡时,容器C的体积是起始时$\frac{3}{4}$,则$\frac{2x+3-3x+1-x}{1+3}$=$\frac{3}{4}$,解得x=0.5,则平衡时容器C中H2的体积分数为$\frac{3-3×0.5}{2×0.5+1-0.5+3-3×0.5}×100%$=50%,
故答案为:50%.
点评 本题考查化学平衡的计算,影响平衡的因素,将不同模型转化为影响平衡的一般因素是解决本题的关键,题目难度中等.

练习册系列答案
相关题目
16.恒温条件下,反应N2(g)+3H2(g)?2NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为$\overline{M}$,N2与NH3的浓度均为c mol/L.若将容器的容积压缩为原来的$\frac{1}{2}$,当达到新平衡时,下列说法中正确的是( )
| A. | 新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L | |
| B. | 新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L | |
| C. | 新的平衡体系中,混合气体的平均摩尔质量小于$\overline{M}$ | |
| D. | 新的平衡体系中,气体的密度是原平衡体系的1倍 |
17. 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )| A. | P4S3中磷元素为+3价 | |
| B. | P4S3属于共价化合物 | |
| C. | P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2 | |
| D. | 1 mol P4S3分子中含有9 mol共价键 |
14.丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的.则第4~5min之间,改变的条件增加H2浓度,第5~6min之间,改变的条件是增加H2O(g)浓度.
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.

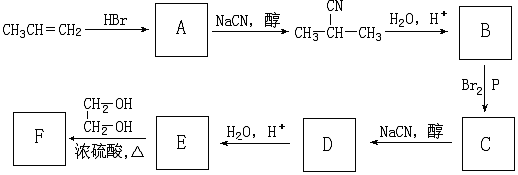
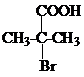 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$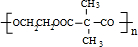 +2nH2O.
+2nH2O.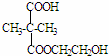 ,②分子内含有一个七元环
,②分子内含有一个七元环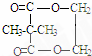 .
.