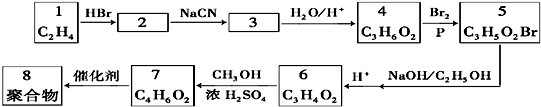
题目内容
7.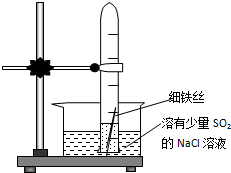 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:(1)观察到试管中的液面逐渐下降,这说明在该条件下,铁丝发生了析氢腐蚀,正极材料是C电极反应是2H++2e-=H2↑
(2)再过一段时间发现液面停止下降,并且开始逐渐上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了吸氧腐蚀,正极的电极反应为O2+4e-+2H2O=4OH-
①总反应为:2Fe+O2+2H2O═2Fe(OH)2;①反应的产物极易被进一步氧化,生成红褐色物质,
②该反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3若铁锈的组成为:Fe2O3•xH2O,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O
附加题:
(3)已知原来铁丝质量为2g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为1.986g,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气6.72mL,若x值为2,那么铁丝的质量应为2.003g(以上计算有效数字保留至小数点后三位)
分析 (1)酸性条件下,Fe发生析氢腐蚀,C作正极,正极上氢离子得电子;
(2)当溶液的酸性较弱时,发生吸氧腐蚀,正极上氧气得电子生成氢氧根离子;
①负极上Fe失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子;
②反应生成的Fe(OH)2被氧气氧化为氢氧化铁;氢氧化铁分解生成Fe2O3•xH2O;
(3)根据生成的氢气求出转移的电子的物质的量,再根据电子守恒计算Fe的质量;氧气的体积等于氢气的体积加上最终液面的变化值;Fe转化为Fe2O3•xH2O,增加了O的质量和水的质量.
解答 解:(1)酸性条件下,Fe发生析氢腐蚀,C作正极,正极上氢离子得电子,正极反应式为:2H++2e-=H2↑;
故答案为:析氢;C;2H++2e-=H2↑;
(2)当溶液的酸性较弱时,发生吸氧腐蚀,正极上氧气得电子生成氢氧根离子,正极反应式为:O2+4e-+2H2O=4OH-;
故答案为:吸氧;O2+4e-+2H2O=4OH-;
①负极上Fe失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,则发生的总反应为:2Fe+O2+2H2O═2Fe(OH)2;
故答案为:2Fe+O2+2H2O═2Fe(OH)2;
②反应生成的Fe(OH)2被氧气氧化为氢氧化铁,其反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;氢氧化铁分解生成Fe2O3•xH2O,其反应方程式为:2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O;
(3)生成氢气的反应为2H++2e-=H2↑;生成氢气为5.6mL,则n(H2)=0.00025mol,铁电极发生的反应为Fe-2e-=Fe2-,由电子守恒可知,反应的Fe为0.00025mol,则消耗的铁的质量为0.014g,所以铁丝的质量变为2-0.014=1.986g;最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,则被吸收氧气的体积应为5.6+1.12=6.72 mL;设生成氢氧化亚铁为xmol,则0.5x+0.25x=0.03mol,解得x=0.04mol,则Fe2O3•2H2O中水的物质的量为0.04mol,
Fe转化为Fe2O3•2H2O,增加了O的质量和水的质量,则铁丝的质量应为:1.986+$\frac{0.00672L}{22.4L/mol}$×32g/mol+0.0004mol×18g/mol=2.0028g;
故答案为:1.986;6.72;2.0028.
点评 本题考查了金属的电化学腐蚀的实验探究方案设计,题目难度中等,注意把握原电池中正负极上发生的反应以及析氢腐蚀和吸氧腐蚀的发生条件,侧重于考查学生的分析能力和计算能力.

| A. | 16 g CH4与18 g NH4+所含的质子数均为10NA | |
| B. | 将15.6 g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1 L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 2 mol NO和1 mol O2混合,所得气体的分子数为2NA |
| A. | 22.4L CO | B. | 4.4g CO2 | C. | 8 g SO3 | D. | 24.5g H2SO4 |
| A. | NaOH(NaOH) | B. | CuCl2(CuO) | C. | NaCl(HCl) | D. | CuSO4(H2O) |
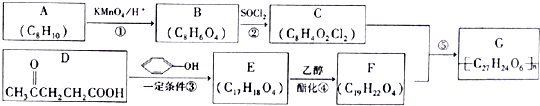
 →
→ +HCl
+HCl ;
;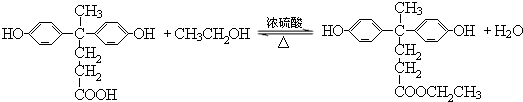 .
.