题目内容
12.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 16 g CH4与18 g NH4+所含的质子数均为10NA | |
| B. | 将15.6 g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1 L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 2 mol NO和1 mol O2混合,所得气体的分子数为2NA |
分析 A、分别求出CH4与NH4+的物质的量,铵根离子中含11个质子来分析;
B、将过氧化钠投入水中后,溶液中除了氢氧化钠外,水也含氧原子;
C、碳酸根的水解会导致阴离子个数增多;
D、2 mol NO和1 mol O2混合后生成2molNO2,但NO2中存在平衡:2NO2?N2O4.
解答 解:A、18gNH4+的物质的量为1mol,而铵根离子中含11个质子,故1mol铵根离子中含11NA个质子,故A错误;
B、将过氧化钠投入水中后,溶液中除了氢氧化钠外,水中也有氧原子,因此反应后溶液中氧原子的总量大于0.4NA,故错误;
C、碳酸根的水解会导致阴离子个数增多,溶液阴离子有CO32-、HCO3-、OH-,因此阴离子总数一定大于0.1NA,故C正确;
D、2 mol NO和1 mol O2混合后生成2molNO2,但NO2中存在平衡:2NO2?N2O4,因此气体的分子数小于2NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
17.下列事实可证明醋酸是弱酸的是( )
| A. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 | |
| B. | 用醋酸溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol/L醋酸溶液可以使紫色石蕊试液变红 | |
| D. | 0.1 mol/L醋酸溶液的pH=3 |
4.三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价、再生的水电,相当于每年燃烧5 000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制( )
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大④温室效应 ⑤白色污染.
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大④温室效应 ⑤白色污染.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①②⑤ |
2.NaHCO3俗名小苏打,下面是对NaHCO3采用不同分类法的分类,正确的是( )
| A. | NaHCO3是碱 | B. | NaHCO3是正盐 | C. | NaHCO3是强酸盐 | D. | NaHCO3是酸式盐 |
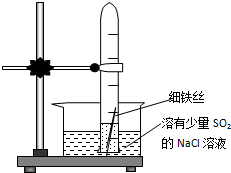 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿: