题目内容
16.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )| A. | NaOH(NaOH) | B. | CuCl2(CuO) | C. | NaCl(HCl) | D. | CuSO4(H2O) |
分析 A.实质是电解水;
B.电池反应式为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑;
C.电池反应式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
D.电池反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
解答 解:A.电解氢氧化钠溶液实质是电解水,需要加入适量的水能使溶液完全复原,故A错误;
B.电池反应式为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,析出的物质相当于CuCl2,需要适量的CuCl2恢复原状,故C错误;
C.电池反应式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,相当于析出HCl,加入HCl能与NaCl反应恢复原状,故C正确;
D.电池反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,相当于析出CuO,加入适量的CuO可以与硫酸铜反应恢复原状,故D错误,
故选:D.
点评 本题考查电解原理,比较基础,关键是理解离子放电顺序,理解掌握电解四种类型:电解水型、电解电解质型、放氧生酸型、放氢生碱型.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
4.三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价、再生的水电,相当于每年燃烧5 000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制( )
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大④温室效应 ⑤白色污染.
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大④温室效应 ⑤白色污染.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①②⑤ |
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 水电离出的c(H+)=10-10 mol•L-1的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
8.下列有关氯气的说法正确的是( )
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,氯水还可杀菌消毒 | |
| B. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| C. | 红热的铁丝在Cl2中燃烧产生棕色的雾;H2在Cl2中燃烧火焰呈淡蓝色 | |
| D. | 氯水长时间放置会变质,是因为氯气几乎完全挥发,剩下的就是水. |
6.下列反应中,生成物的总能量大于反应物总能量的是( )
| A. | 氢气在氧气中燃烧 | B. | 氢气与氯气化合 | ||
| C. | 中和反应 | D. | 焦炭在高温下与水蒸气反应 |
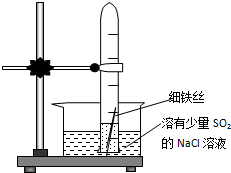 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿: 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义.